Niter: Difference between revisions
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
<bibimport/> | <bibimport/> | ||
Authors: [[user:Hschwarz|Hans-Jürgen Schwarz]], Nils Mainusch, NN.... | Authors: [[user:Hschwarz|Hans-Jürgen Schwarz]], Nils Mainusch, NN.... <br> | ||
Translation of the [http://193.175.110.91/salzwiki/index.php?title=Niter&oldid=11136 German Version] by Hans-Jürgen Schwarz | |||
<br>back to [[Nitrate]] | <br>back to [[Nitrate]] | ||
{{Infobox_Salt | {{Infobox_Salt | ||
Revision as of 12:11, 29 April 2011
<bibimport/>
Authors: Hans-Jürgen Schwarz, Nils Mainusch, NN....
Translation of the German Version by Hans-Jürgen Schwarz
back to Nitrate
| Niter[1][2][3] | |
| KNO3 I (6)-klein.jpg | |
| Mineralogical name | Nitrokalite, Niter, Kalisalpeter |
| Chemical name | Kaliumnitrat |
| Trivial name | Salpeter, Kali-Salpeter, Kehrsalpeter, Konversionssalpeter |
| Chemical formula | KNO3 |
| Other forms | keine |
| Crystal system | {{{Crystal_System}}} |
| Crystal structure | see [4] |
| Deliquescence humidity 20°C | 94,6 |
| Solubility (g/l) at 20°C | 315 g/l |
| Density (g/cm³) | 2,109 g/cm3 |
| Molar volume | 48,04 cm3/mol |
| Molar weight | 101,11 g/mol |
| Transparency | translucent to transparent |
| Cleavage | very good on {001}; good on {010}h[5] |
| Crystal habit | include crusts and acicular crystals formed as efflorescence on cave and mine walls [6] |
| Twinning | |
| Phase transition | |
| Chemical behavior | easily soluble in water |
| Comments | |
| Crystal Optics | |
| Refractive Indices | α = 1,335 β = 1,505 γ = 1,506 |
| Birefringence | Δ = 0,171 |
| Optical Orientation | biaxial negative |
| Pleochroism | |
| Dispersion | weak, r < v |
| Used Literature | |
| {{{Literature}}} | |
Abstract[edit]
Niter ist eines der wichtigsten Salze, die an z. B. Bauwerken und Wandmalereien für Schäden verantwortlich sind. Insbesondere in Innenräumen ist er häufig als sichtbare, oft watteartige Ausblühungen zu finden. Abbildungen, Mikroaufnahmen und Beispiele aus der Praxis ergänzen und veranschaulichen das Dargelegte.
Allgemeines[edit]
Kalisalze waren bis in das 19. Jh. ein wichtiger Rohstoff für die Herstellung von Schieß- und Sprengstoffen und wurden natürlichen Lagern entnommen (Kalilagerstätten enthalten neben diversen Kalirohsalzen maximal etwa 10% KNO3) oder aber durch Umwandlung von Natriumnitrat mittels Kaliumchlorid gewonnen. Derzeitig existieren unterschiedliche Verfahren großtechnischer Herstellung des Salzes durch die Umsetzung von Kalirohsalzen mit Salpetersäure.
Anwendung findet Kaliumnitrat gegenwärtig in der Landwirtschaft als Düngemittel.
Occurrence of Niter[edit]
In Form einer natürlichen Ablagerung kann Kaliumnitrat überall dort entstehen, wo (beispielsweise im Zuge der Verwesung organischer Materie) Stickstoffverbindungen synthetisiert werden und in ausreichender Menge Kaliumionen vorliegen. Großen Mengen nitrifizierbarer Bestandteile und Stickstoffverbindungen sind bekanntermaßen in Dung und Harn von Lebewesen enthalten.
Informations on the origin and formation of Niter on monuments[edit]
Als wesentliche Eintragsquellen für Kaliumionen kommt belastetes Grundwasser und der Eintrag aus mit NOx -belasteter Luft durch Immission in Betracht. Zudem können Bau- und Restaurierungsmaterialien lösliche Kaliumverbindungen enthalten. Erwähnt seien Kaliwasserglas, Kalilauge (als Reinigungsmittel) und Zemente.
Nitrate können aus biogenen Quellen stammen und über kapillaren Feuchtetransport in das Materialgefüge gelangen. Als wichtige mögliche Nitratquelle ist mikrobielle Aktivität durch Nitrifikanten anzuführen.
Solution behavior[edit]
Author: Stark, Jochen; Stürmer, Sylvia
 )
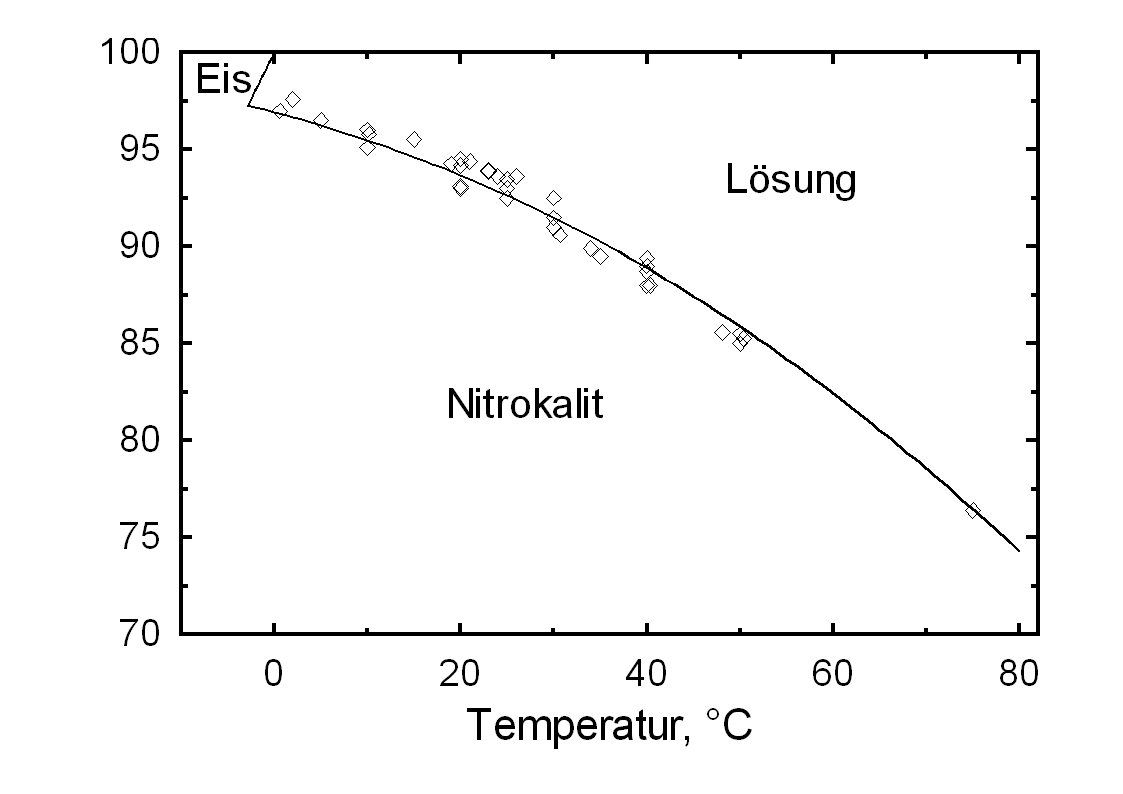
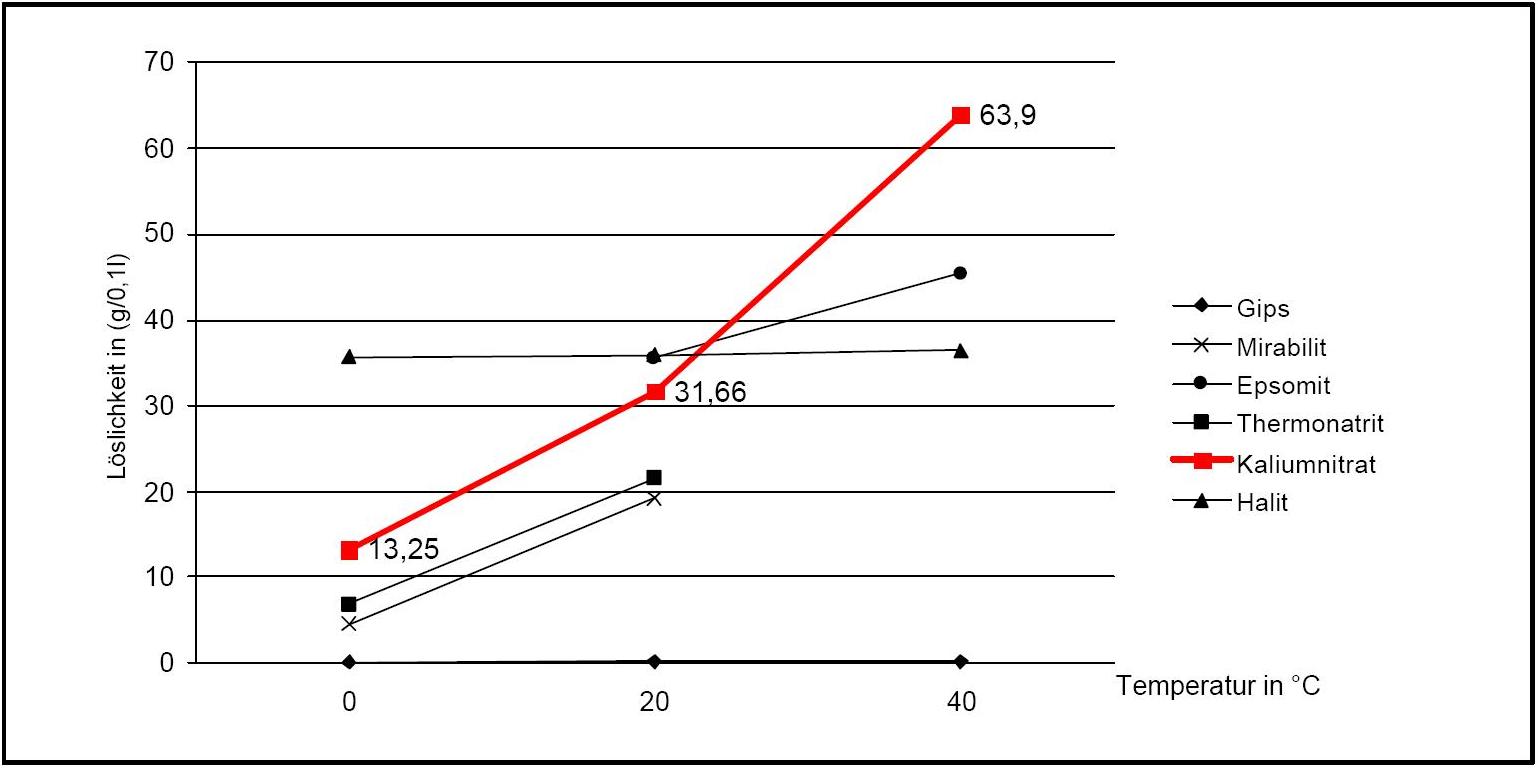
)Kaliumnitrat besitzt eine gute Wasserlöslichkeit und zählt somit zur Gruppe der mobilen Salze, was mit häufigen Veränderungen der Anreicherungszonen am Objekt verbunden sein kann. Der Temperatureinfluss auf die Wasserlöslichkeit ist hoch, was am steilen Kurvenverlauf in Diagramm 1 abzulesen ist.
Verbunden ist hiermit die Gefahr einer Lösungsübersättigung bei raschem Temperaturabfall und einer Kristallisation des Salzes.
Hygroscopicity[edit]
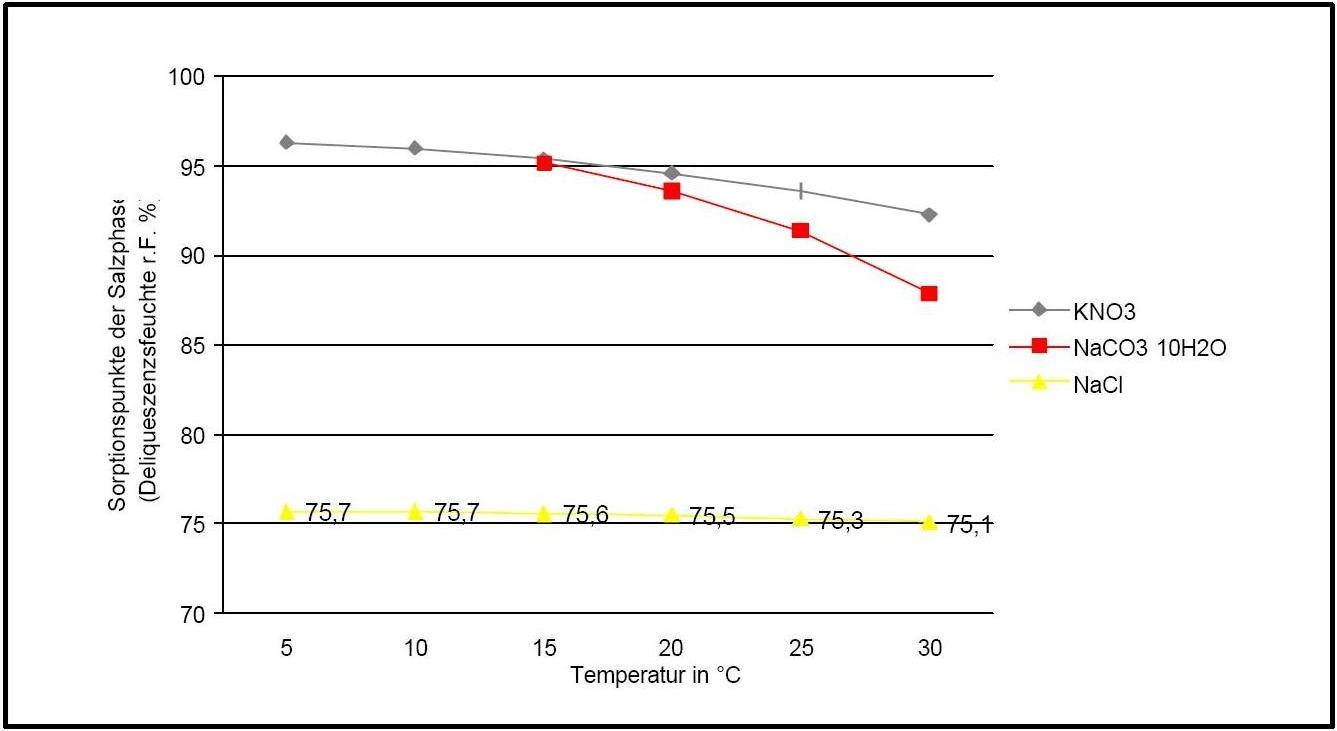
Die Deliqueszenzfeuchte von Kaliumnitrat liegt im Temperaturbereich von 0°C bis 30°C stets über 90% r.F. und ist vergleichsweise linear. Sie wird unter dem Einfluss von Fremdionen allerdings deutlich nach unten verschoben.
| 0°C |
5°C |
10°C |
15°C |
20°C |
25°C |
30°C |
| 96,3%r.F. |
96,3%r.F. |
96%r.F. |
95,4%r.F. |
94,6%r.F. |
93,6%r.F. |
92,3%r.F. |
| MgSO4 | Ca(NO3)2 | Na2SO4 | NaCl | |
| KNO3 | 78% rF |
51% rF |
81% rF |
67% rF |
Feuchtesorption[edit]
Die Feuchtesorption von Kaliumnitrat nach 56 Tagen liegt bei einer Lagerungsfeuchte von 87% r.F . erst bei 6 M% (vgl. Tablle 1). Bei niedrigeren Lagerungsfeuchten von 81% oder 79% konnte keine Feuchtesorption festgestellt werden. Unter gleichen Bedingungen konnte mit einer Mischung (1:1) von Kaliumnitrat und Natriuchlorid eine Feuchtesorption bei 87% r.F. von 221 M%, bei 81% r.F. von 130 M% und bei 79% r.F. von 70 M% gemessen werden.[(vgl. Tabelle 1)
| Storage humidity | 87%r.H. | 81%r.H. | 79%r.H. |
| KNO3 | 6 | 0 | 0 |
|
KNO3 + NaCl (1:1 molare Mischung) |
221 | 130 | 70 |
Sorption behavior of Potassium-nitrate [after [Vogt.etal:1993]Title: Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe
Author: Vogt, R.; Goretzki, Lothar ]
]
Analytical proof[edit]
Microscopy[edit]
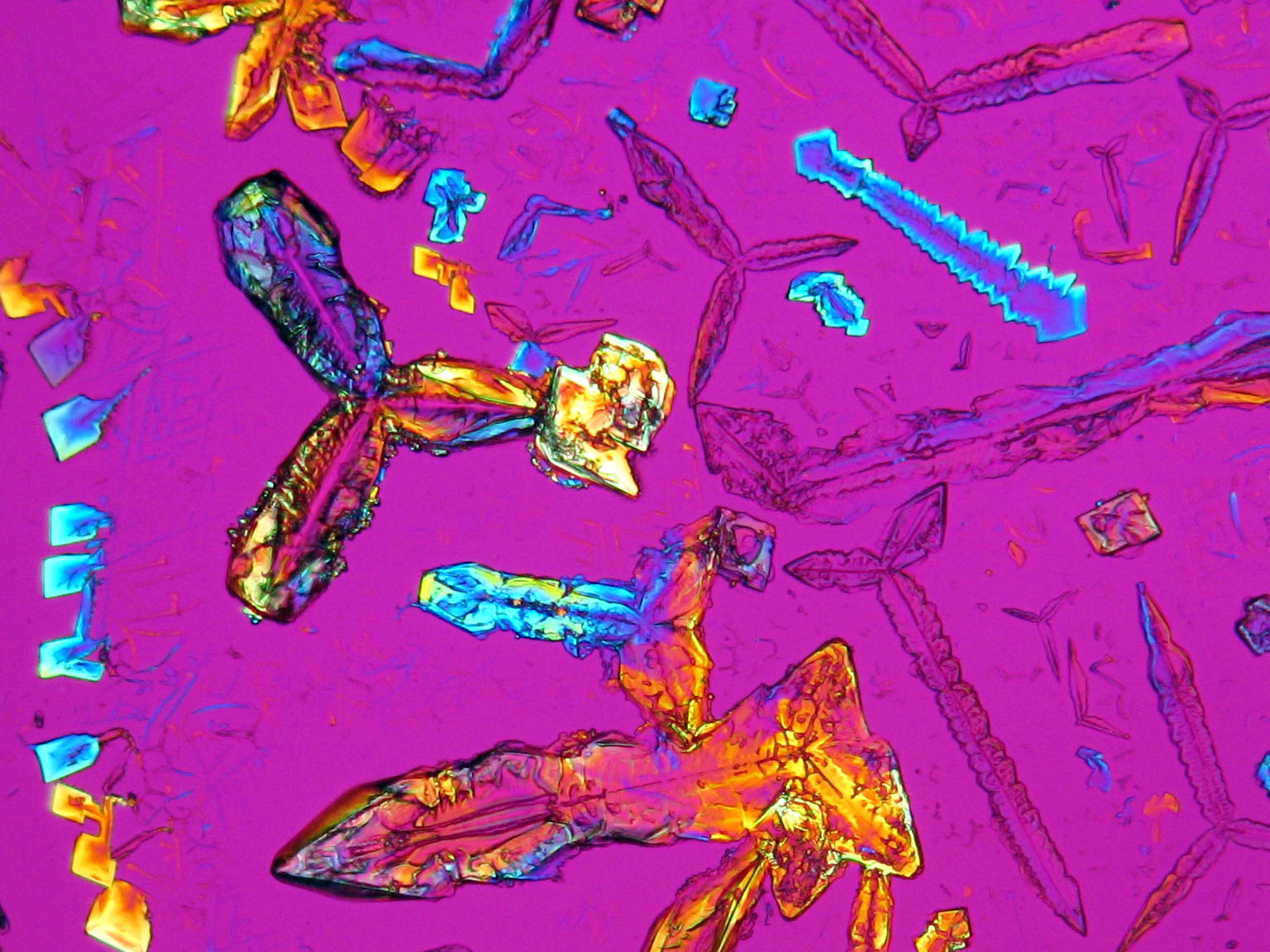
Laboratory Investigations: Bei langsamer Rekristallisation eines überwiegend aus Kaliumnitrat bestehenden Präparates werden tafelig-flache, rhombenförmige Kristalle und lattige oder stäbchenförmige Partikel ausgefällt. Insbesondere zu Beginn der Rekristallisation von Kaliumnitrat aus wässerigen Lösungen wie auch aus Lösungen mit geringem Fremdionenanteil, lässt sich eine charakteristische Bildung rhombenförmiger Kristalle beobachten, die am Lösungstropfenrand entstehen. Unter starkem Einfluss von Fremdionen (bei hoher Fremdionenkonzentration im Ausgangsmaterial) können die oben beschriebenen morphologischen Charakteristika nahezu wegfallen, und es treten unspezifischere Kristallformen des Kaliumnitrates auf. Der pH-Wert von überwiegend kaliumnitrathaltigen Präparaten liegt im neutralen Bereich, die Hygroskopizität ist gering.[Mainusch:2001]Title: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Author: Mainusch, Nils
Refractive indices: nx = 1,335; ny =1.505; nz =1.506
Birefringnece: Δ = max. 0,171
Crystal class: orthorhombic
Investigations with the polarizing microscope
Die Zuweisung der Brechungsindizes von Kaliumnitrat erfolgt entsprechend der Immersionsmethode, wobei die Einbettung in Standard-Immersionsöl mit dem Brechungsindex nD=1,518 bereits alle notwendigen Beobachtungen ermöglicht. Aufgrund der hohen maximalen Doppelbrechung zeigt Kaliumnitrat lebhafte Interferenzfarben. Zur korrekten Zuweisung der höchsten Interferenzfarbe empfiehlt es sich, den Rot I -Kompensator zu benutzen.
Die Auslöschung ist parallel oder symmetrisch. Im Regelfall tritt beim Einschwenken in die Normalstellung an elongierten Kristallen eine gut beobachtbare parallele Auslöschung auf. Symmetrische Auslöschung kann an rhombenförmigen Partikeln beobachtet werden.
Die Abbildungen weiter unten veranschaulichen einen Spezialfall im Auslöschungsverhalten an elongierten Kristallen. Was zunächst als eine schiefe Auslöschung gedeutet werden kann, erweist sich bei detaillierter Betrachtung der Einzelkristalle und der Klärung der tatsächlich vorliegenden Symmetrieebenen als parallele und symmetrische Auslöschung.
Mix up
Potassium nitrate is clearly identifiable. The data in the table below show salts which have refractive indices that are similar to those of potassium nitrate, however, there are clear distinguishing features.
| Salt Phase | Distinguishing Features to Niter |
| Nitronatriet, NaNO3 | |
| Nitromagnesite, Mg(NO3)2 • 6H2O | inclined extinction/ hygroscopic |
| Nitrocalcite, Ca(NO3)2 • 4H20 | significantly lower birefringence/inclined extinction/hygroscopic |
Niter in mixed systems (after ch [Mainusch:2001]Title: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Author: Mainusch, Nils )
)
Im Mischsystem K+-NO32-– Ca2+-SO42- werden aufgrund des hohen Fremdionenanteils stark verwachsene KNO3-Kristalle ausgebildet. Die Tendenz, in großteiligen und länglich geformten Partikeln zu kristallisieren, bleibt beim Kaliumnitrat bestehen. Verfolgt man den Prozess der Rekristallisation, so ist die zeitlich frühere Bildung von Gipskristallen klar nachzuvollziehen. Im vorliegenden, komplexen Mischsystem werden neben Kaliumnitrat und Gips als Hauptkomponenten noch andere Salzphasen wie Kaliumsulfat und Kalium-Calcium-Doppelsalze gebildet (Calciumnitrat konnte nicht festgestellt werden). Der Nachweis aller Salzphasen, die in diesem Mischsystem entstehen können, ist mit einigem Aufwand bei der Trennung und Präparation verbunden. Hilfreich ist es, sich bei der Präparation und der Trennung die Unterschiede der Wasser- und Ethanollöslichkeiten der Salze zunutze zu machen.
Bei der Betrachtung des zweiten Mischsystems (K+-NO32- – Na+- Cl-) zeigt sich, daß der Ausfall von gut ausgebildeten KNO3-Einzelkristallen kurz vor der Bildung isotroper Halitkristalle einsetzt. Dies entspricht den geringfügigen Löslichkeitsunterschieden der beiden Salze. Als Produkte ist es möglich, Kaliumnitrat und Halit nachzuweisen.
Niter and damages caused by niter in the image[edit]
On objects[edit]
Under the polarizing microscope[edit]
- KNO<sub
Weblinks[edit]
- ↑ http://webmineral.com/data/Niter.shtml gelesen 28.07.2010
- ↑ http://www.mindat.org/min-2917.html
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Niter
- ↑ http://webmineral.com/jpowd/JPX/jpowd.php?target_file=Niter.jpx; Viewed on 15/04/2011
- ↑ ttp://en.wikipedia.org/wiki/Niter; Viewed on 15/04/2011
- ↑ http://www.galleries.com/minerals/carbonat/niter/niter.htm; Viewed on 15/04/2011
Literature[edit]
[Filter missing]