Thenardite
<bibimport/>
| Thenardite[1][2] | |

| |
| Mineralogical name | Thenardite |
| Chemical name | Sodium sulphate |
| Trivial name | Pyrotechnite |
| Chemical formula | Na2SO4 |
| Other forms | Mirabilite (Na2SO4•10H2O) Sodiumsulphate heptahydrate (Na2SO4•7H2O) |
| Crystal system | orthorhombic |
| Crystal structure | |
| Deliquescence humidity 20°C | 81,7% (25°C) |
| Solubility (g/l) at 20°C | 162 g/l |
| Density (g/cm³) | 2,689 g/cm³ |
| Molar volume | 53,11 cm3/mol |
| Molar weight | 142,04 g/mol |
| Transparency | transparent to translucent |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | soluble in water and glycerin, not soluble in pure alcohol |
| Crystal Optics | |
| Refractive Indices | nx = 1,468 ny = 1,473 nz = 1,483 |
| Birefringence | Δ = 0,015 |
| Optical Orientation | positive |
| Pleochroism | |
| Dispersion | |
| Used Literature | |
| {{{Literature}}} | |
Authors: Hans-Jürgen Schwarz , Michael Steiger, Tim Müller
English translation: Matthieu Angeli
back to Sulphate
Sodium sulphate and thenardite[edit]
Abstract[edit]
Sodium sulphate and its phases thenardite, mirabilite and the heptahydrate, whose importance in the production of damage has been identified, are described.
Introduction[edit]
Occurence[edit]
Both thenardite like mirabilite appear as natural minerals. Sodium sulphate appears in Nature in mineral waters in the form of double salts, as deposits of former salt lakes. Knowledge of the hydrated sodium sulphate dates back to the 16th Century. Its first description has been written by Glauber in 1658, in which he described it as "sal mirable". It is also quite common to read the name "Glauber's salt" for mirabilite in the literature.
Information on the origin and formation of thenardite / mirabilite in monuments[edit]
With the entry of materials that contain soluble sodium compounds, the mineral system of a monument may create sodium sulphate as salt efflorescence when acting with various sources of sulphate such as for example sulphurous gases or contaminated air. Cement exhibits a high content of sodium ions, as they are allowed by the German Standardization Institute to contain up to 0.5 % of soluble alkalis. This means that 100 kg of Portland cement containing only 0.1% soluble Na2O can form 520g of Mirabilite when in contact with air containing sulphuric acid [calculation from Arnold/Zehnder 1991]. Sodium ions can also enter into monuments from a plethora of cleaning materials and especially older restoration products (such as water glass). Ground water and surface water are also a possible source of Na+-ions. Road salt consists to a large part of slightly soluble sodium chloride. Finally, in the coastal areas, sea water is also a significant source of NaCl.
Solubility behavior[edit]
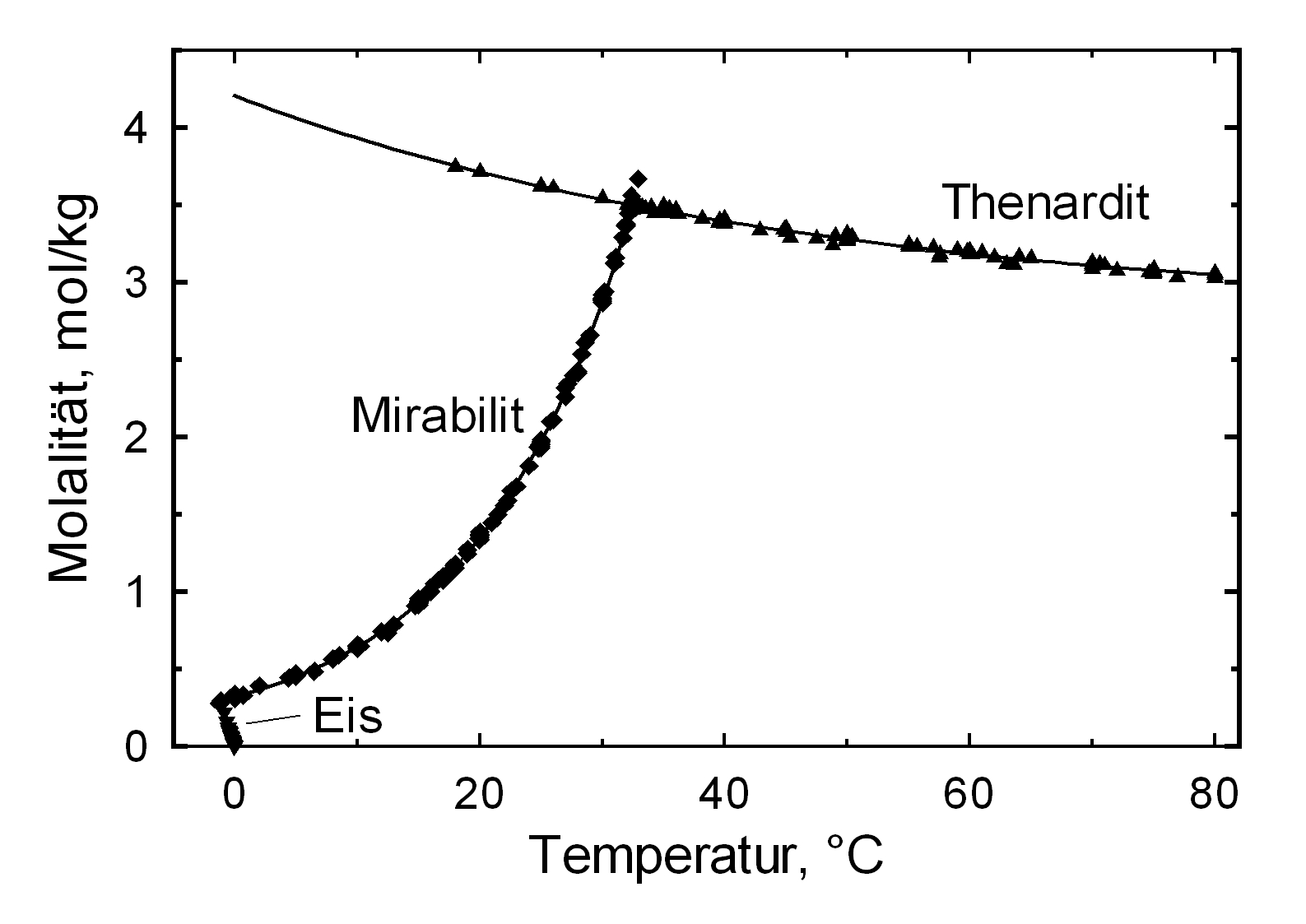
The structures of both thenardite and mirabilite belong to the group of easily soluble salts and therefore easily mobilizable (see Table hygroscopicity of the salts and ERH). The solubility of sodium sulphate is highly dependent on temperature. For this reason, a rapid drop of temperature is highly likely to yield very high supersaturation and salt crystallization.
Hygroscopicity[edit]
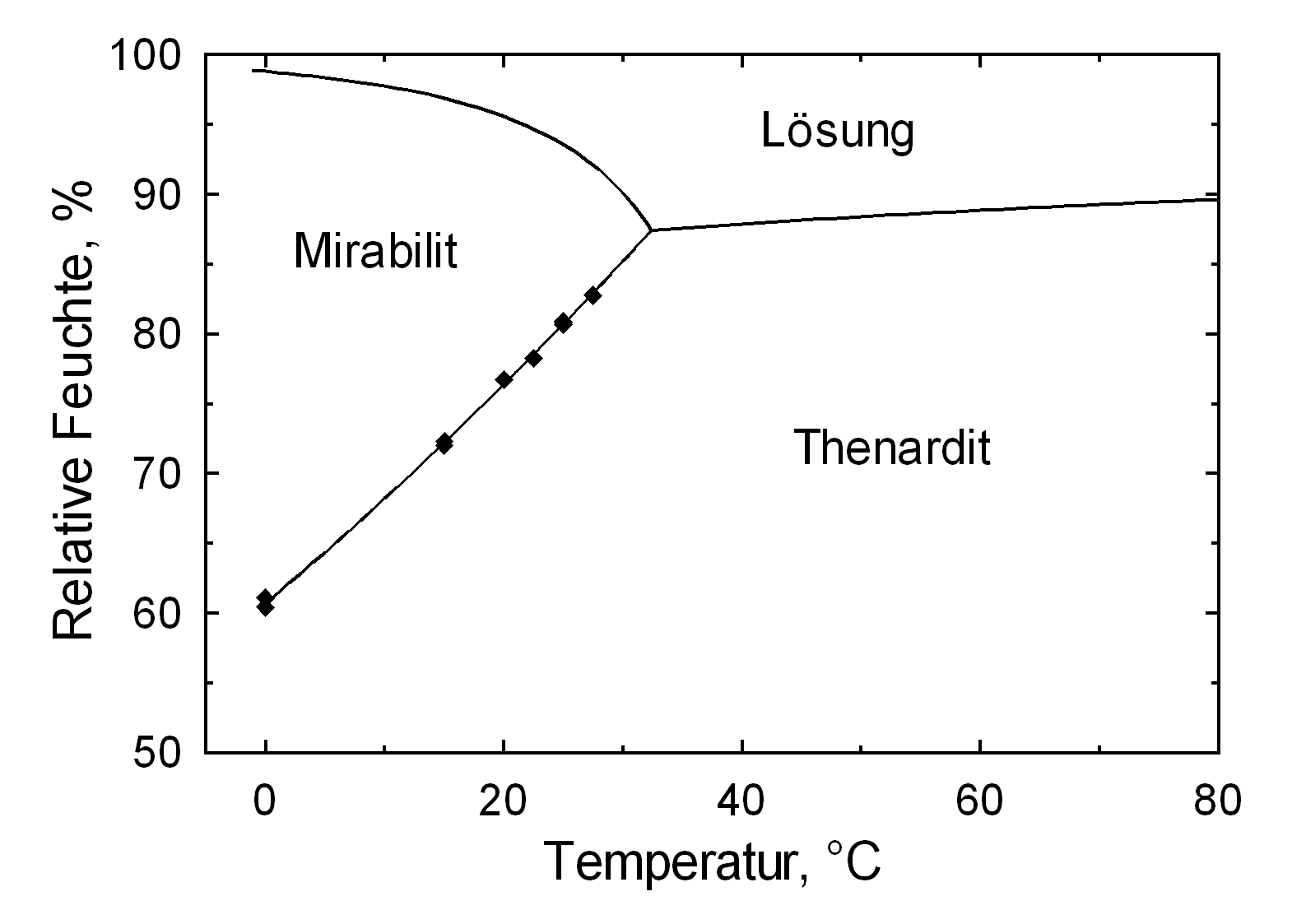
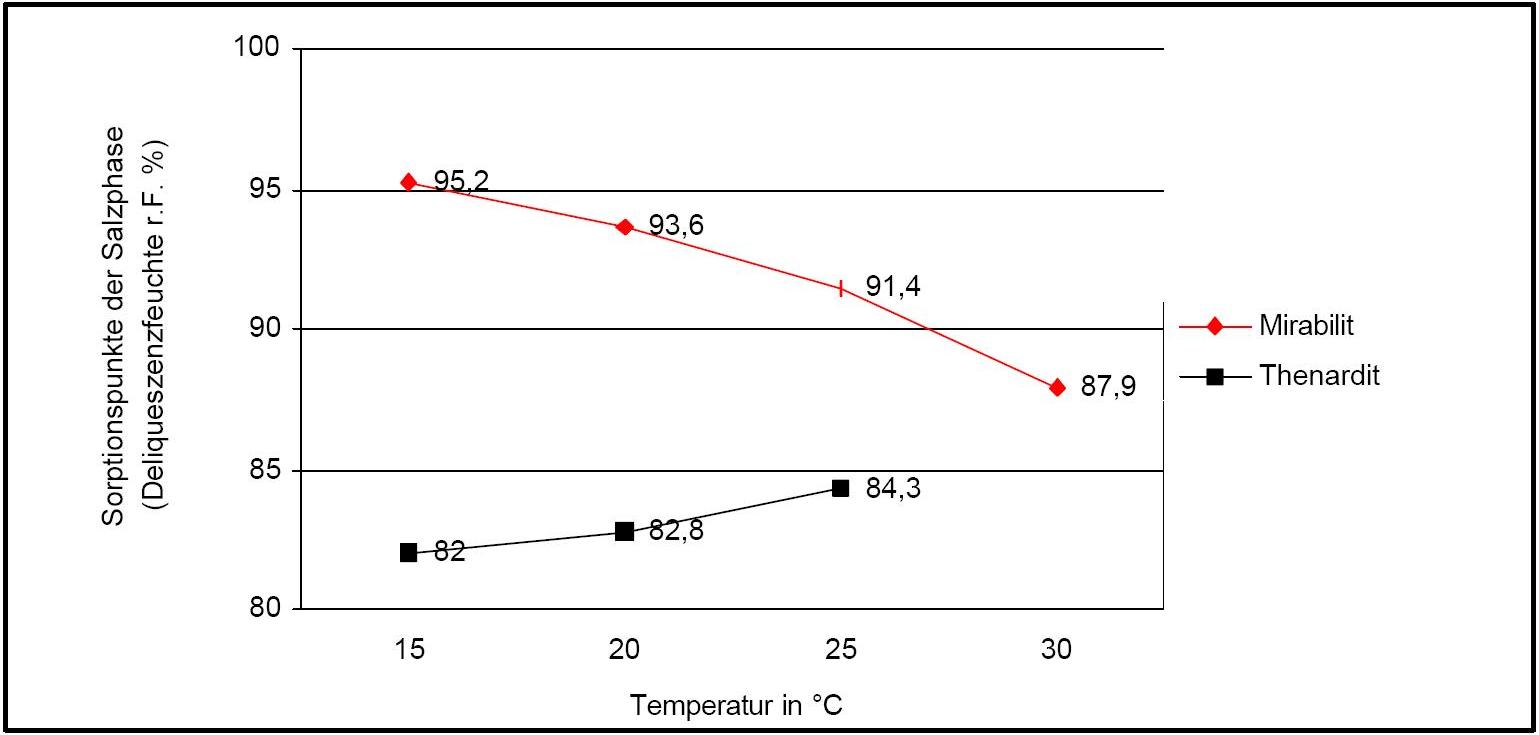
The temperature effect on the deliquescence points of thenardite and mirabilite is shown below. The striking features here are the opposite curve transitions. In the presence of other ions (in salt mixtures), the parameters of the equilibrium moisture content as well as the necessary temperature and humidity conditions for recrystallization change significantly. The following table shows experimental data of equilibrium moisture for different salt mixtures at different temperatures.It turns out that all the values of equilibrium moisture content are lower than those of pure salt mirabilite (see table equilibrium moisture content as a function of temperature).
| MgSO4 | Ca(NO3)2 | KNO3 | |
| Na2SO4 • 10H2O | 87(21°C) | 74 (21°C) | 81(21°C) |
Water vapor sorption:
Author: Arnold, Andreas; Zehnder, Konrad

Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben:
| Lagerungsfeuchte | 87% r.F. | 81% r.F. | 79% r.F. |
| Na2SO4 | 79 | 0 | 0 |
| Na2SO4+NaCl (1:1 molare Mischung) | 157 | 32 | 15 |
Crystallization pressure[edit]
Bei der Kristallisation aus wäßriger Lösung läßt sich für Thenardit ein Kristallisationsdruck von 29,2-34,5 N/mm2 angeben. Im Vergleich mit den berechneten Angaben der Kristallisationsdrücke anderer bauschädlichen Salze kann Thenardit einen hohen Kristallisationsdruck aufbauen [Winkler:1975]Title: Stone: Properties, Durability in Man´s Environment
Author: Winkler, Erhard M. .
.
Hydration behavior[edit]
Das System Na2SO4 – H2O:
Als nachweisbare, stabile Hydratstufen existieren lediglich das Anhydrit (Thenardit) und das Dekahydrat (Mirabilit). Die Erzeugung von Mirabilit kann durch Rekristallisation des Salzes aus übersättigter, wäßriger Lösung bei einer Temperatur von unter 32,4°C erfolgen. Insbesondere aufgrund der Hydratstufenbildung, der mit einem Einbau von 10 Wassermolekülen in das Kristallgitter und einer Volumenexpansion von rund 320% verbunden ist und der niedrigen Übergangstemperatur von ca. 32-35°C zählen Natriumsulfate zu den sehr verwitterungsaktiven Schadsalzen. Auch dieser Wert ist als Richtwert zu verstehen. Der Phasenübergang Mirabilit – Thenardit kann bei einer Temperatur von 25 °C bei einer relativen Feuchte von ca. 80% stattfinden, beträgt die Umgebungstemperatur 0°C, so ist ein Übergang bereits bei einer r.F. von 60,7% möglich [Angaben nach Gmelin]. Es zeigt sich also auch hier ein starker Temperatureinfluß. Eine Abschätzung der Schadensaktivität durch Kristallisations- und Hydratationsprozesse der Natriumsulfate wird sich an einem Bauwerk bei varierenden Einflußgrößen also sehr schwierig darstellen, da die Klimaparameter das Verhalten extrem beeinflussen.
The importance of the heptahydrate in the damage process[edit]
Hydration pressure[edit]
Der Hydratationsdruck, der beim Übergang von Thenardit zu Mirabilit aufgebaut wird, ist stark abhängig von den bestehenden Luftfeuchte- und Temperatur-verhältnissen, was in der nachstehenden Tabelle verdeutlicht ist:
| rel. Feuchte % | 20,0 °C | 25,0 °C | 30,0 °C |
| 100 | 48,9 N/mm2 | 40,5 N/mm2 | 28,9 N/mm2 |
| 95,0 | 41,3 N/mm2 | 32,7 N/mm2 | 23,3 N/mm2 |
| 90,0 | 33,5 N/mm2 | 24,9 N/mm2 | 13,7 N/mm2 |
| 85,0 | 25,5 N/mm2 | 16,0 N/mm2 | 5,1 N/mm2 |
| 80,0 | 16,4 N/mm2 | 7,8 N/mm2 | 0,0 |
| 75,0 | 6,7 N/mm2 | 0,0 | - |
Die Volumenveränderung, die beim Phasenübergang stattfindet, ist mit ca. 320% anzugeben [Sperling.etal:1980]Title: Salt Weathering on Arid Environment, I. Theoretical ConsiderationsII. Laboratory Studies
Author: Sperling, C.H.B.and Cooke, R.U. .
.
Analytical detection[edit]
Microscopy
[edit]
Laboruntersuchung:
Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und Mirabilit besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.
Brechungsindizes: nx = 1,468; ny =1,473; nz =1,483
Doppelbrechung: Δ = 0.015
Kristallklasse: orthorhombisch
Polarisationsmikroskopische Investigation:
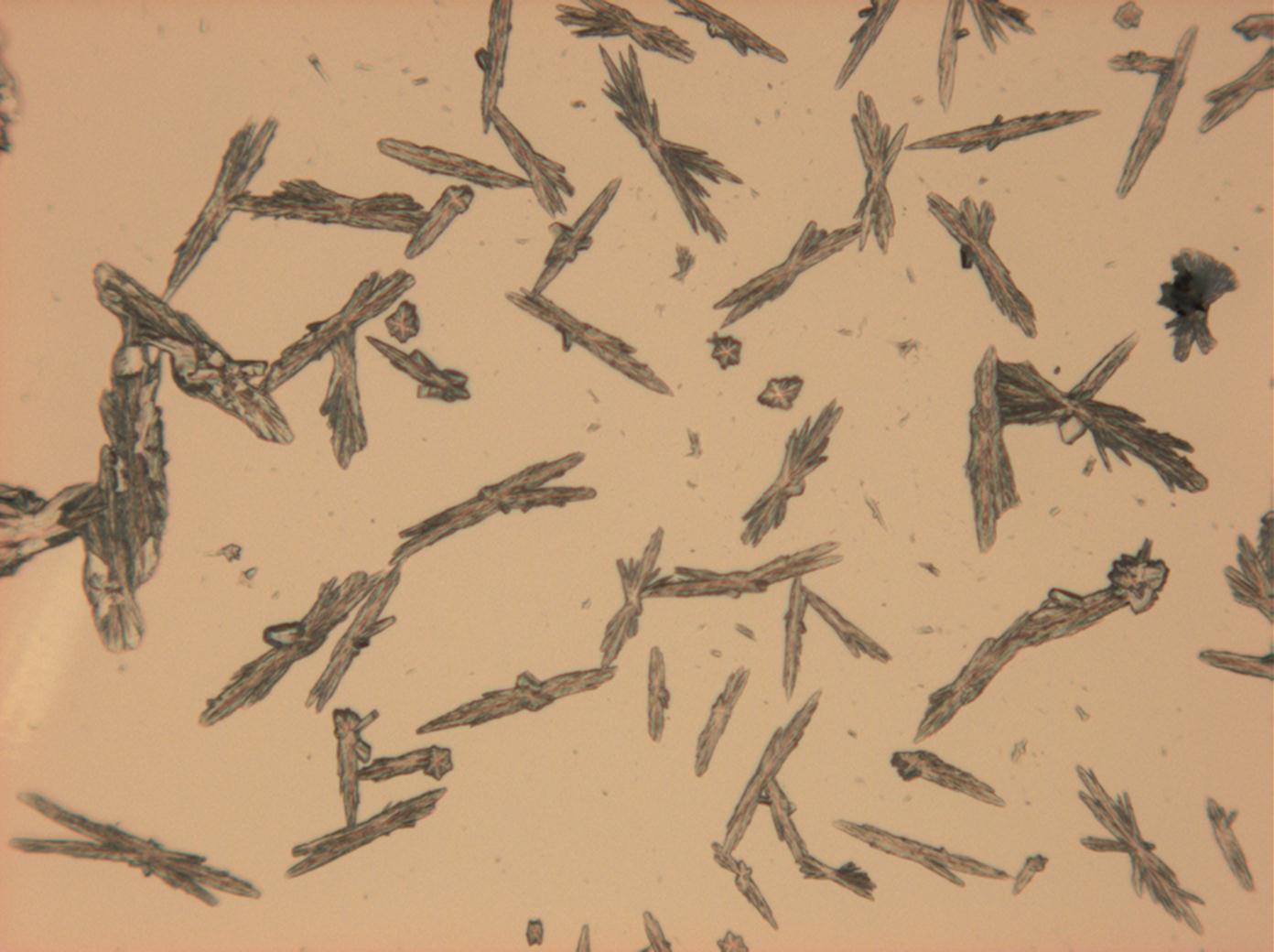
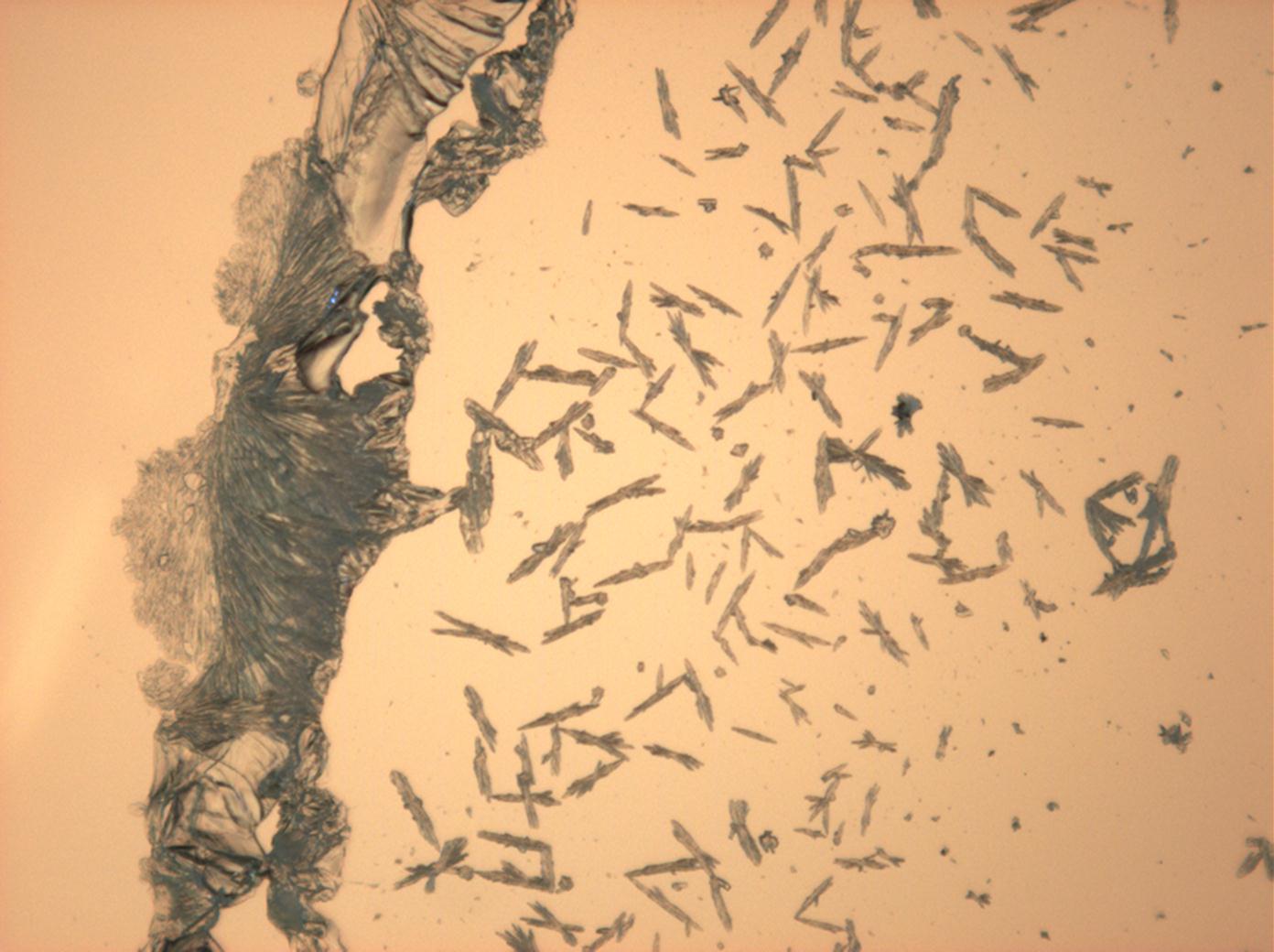
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert Mirabilit sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozess der Rekristallisation beobachtet wird. Mirabilit weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.
Die Zuweisung der Brechungsindizes von Thenardit erfolgt entsprechend der Immersionsmethode. Aufgrund der niedrigen maximalen Doppelbrechung zeigt Thenardit zumeist graue Interferenzfarben. Die Auslöschung ist parallel oder symmetrisch.
Verwechslungsmöglichkeiten:
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem nD-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden.
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich Mirabilit in der hohen Hydratstufe zu identifizieren und somit indirekt Thenardit nachzuweisen.
| Salzphase | Unterscheidungsmerkmal |
| Boussingaultit (NH4)2Mg(SO)4 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Pikromerit K2Mg(SO4)2 • 6H20 | keine anormalen Interferenzfarben / schiefe Auslöschung |
| Bloedit Na2Mg(SO4)2 • 6H20 | alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert. |
| Glaserit K3Na(SO4)2 | alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung |
| Arcanit K2SO4 | alle Indizes >1,48 / keine anormalen Interferenzfarben |
| Magnesiumformiat Mg(HCO2)2 • 2H2O | vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung |
Betrachtung von Mischsystemen:
Mischsystem Na+– Ca2+– SO4 2-: Der Ausfall von Gips erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch.
Mischsystem Na+– SO4 2-– Cl-: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt.
Pictures of salt and salt damage[edit]
Am Objekt[edit]
- Thenardit Ausblühungen an Objekten
- Eilsum Gipsausbluehungen.jpg
Thenarditausblühungen in der Ev. Ref. Kirche in Eilsum
Under the polarized microscope[edit]
- Natriumsulfat-Kristalle zwischen zwei Objektträgern kristallisiert
- NNatriumsulfat-Kristalle , kristallisiert aus wässriger Lösung von Realproben
Unter dem Rasterelektronenmikroskop[edit]
Weblinks
[edit]
- ↑ http://webmineral.com/data/Thenardite.shtml viewed on 29/07/2010
- ↑ http://www.mindat.org/min-3935.html viewed on 29/07/2010
Literatur[edit]
[Filter missing]