Niter
Authors: Hans-Jürgen Schwarz, Nils Mainusch, NN....
Translation of the German Version by Hans-Jürgen Schwarz
back to Nitrate
| Niter[1][2][3] | |

| |
| Mineralogical name | Nitrokalite, Niter, Kalisalpeter |
| Chemical name | Potassium nitrate |
| Trivial name | Saltpetre , Nitrate of potash, Vesta powder, Kali-Salpeter, Kehrsalpeter, Konversionssalpeter |
| Chemical formula | KNO3 |
| Other forms | none |
| Crystal system | orthorhombic |
| Crystal structure | orthorhombic - dipyramidal; 2/m 2/m 2/m , see [4] |
| Deliquescence humidity 20°C | 94.6 % (20°C), 93.6% (25°C) |
| Solubility (g/l) at 20°C | 315 g/l |
| Density (g/cm³) | 2.109 g/cm3 |
| Molar volume | 48.04 cm3/mol |
| Molar weight | 101.11 g/mol |
| Transparency | translucent to transparent |
| Cleavage | very good on {001}; good on {010}h[5] |
| Crystal habit | include crusts and acicular crystals formed as efflorescence on cave and mine walls [6] |
| Twinning | |
| Phase transition | |
| Chemical behavior | easily soluble in water |
| Comments | |
| Crystal Optics | |
| Refractive Indices | α = 1.335 β = 1.505 γ = 1.506 |
| Birefringence | Δ = 0.171 |
| Optical Orientation | biaxial negative |
| Pleochroism | |
| Dispersion | weak, r < v |
| Used Literature | |
| {{{Literature}}} | |
Abstract[edit]
Niter is one of the most important salts that is responsible for damages of buildings and murals. He is mostly observed indoors, often found in cotton-like efflorescences. Pictures, microphotographs and examples of habits illustrate and complement the description.
General[edit]
Potassium salts were an important ingredient for the production of gun and explosives in the 19th century, and were both originating from natural sources (potash deposits contain a maximum of 10% KNO3 among various other potassium salts) and obtained through the transformation of sodium nitrate into potassium chloride. Currently various methods of large-scale production of this salt are based on the reaction between crude potassium salts and nitric acid.
Potassium nitrate is also used as a fertilizer in agriculture.
Occurrence of Niter[edit]
Potassium nitrate in natural accumulations can occur anywhere where nitrogen compounds are synthesized in presence of a sufficient quantity of potassium ions (for example during the decomposition of organic matter). Large quantities of nitrifying bacteria and nitrogen compounds are known to be present in manure and urine of living organisms.
Information on the origin and formation of Niter on monuments[edit]
Contaminated ground water is the major input source of potassium ions in monuments, and nitrates most commonly come from atmospheric pollution. In addition, building and restoration materials can also contain soluble potassium compounds. We can also mention potassium silicate, potassium hydroxide (used as a cleaning agent) and cements.
Nitrates can also originate from biogenic sources and be transported into the material structure via capillary transport of moisture. Microbial activity is an important potential source of nitrates through nitrifying bacteria.
Solution behavior[edit]
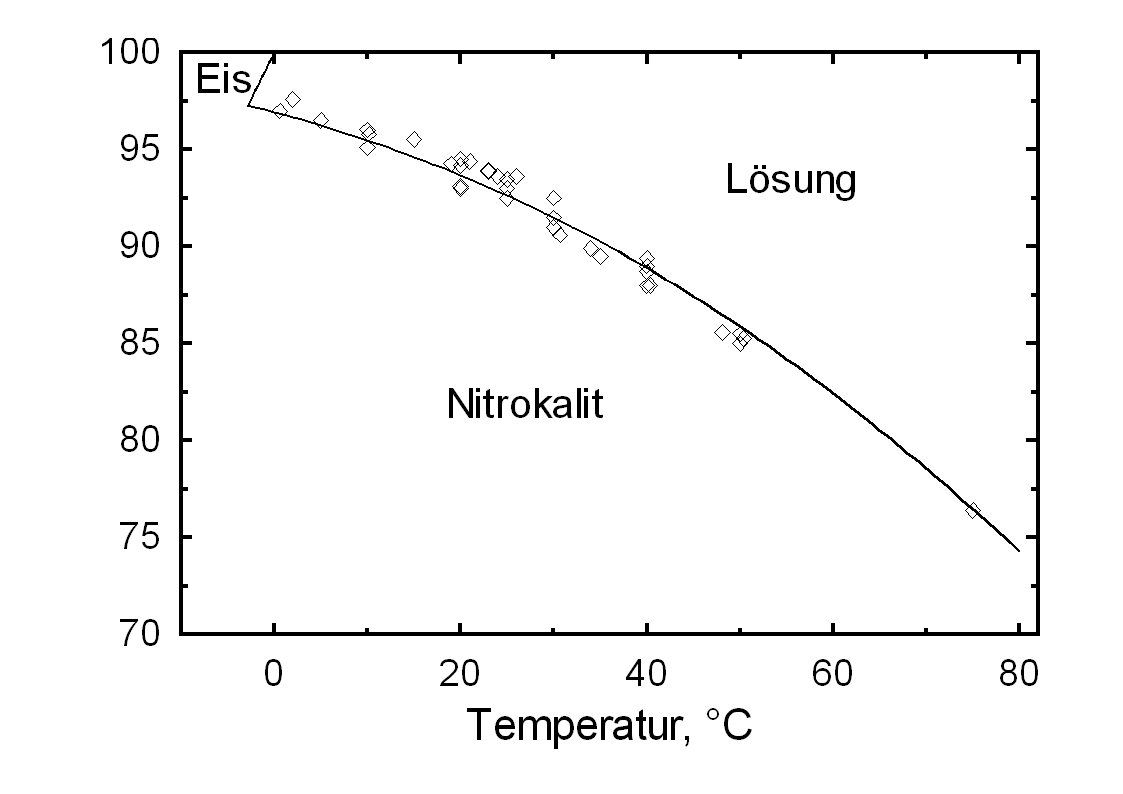
Author: Stark, Jochen; Stürmer, Sylvia
 )
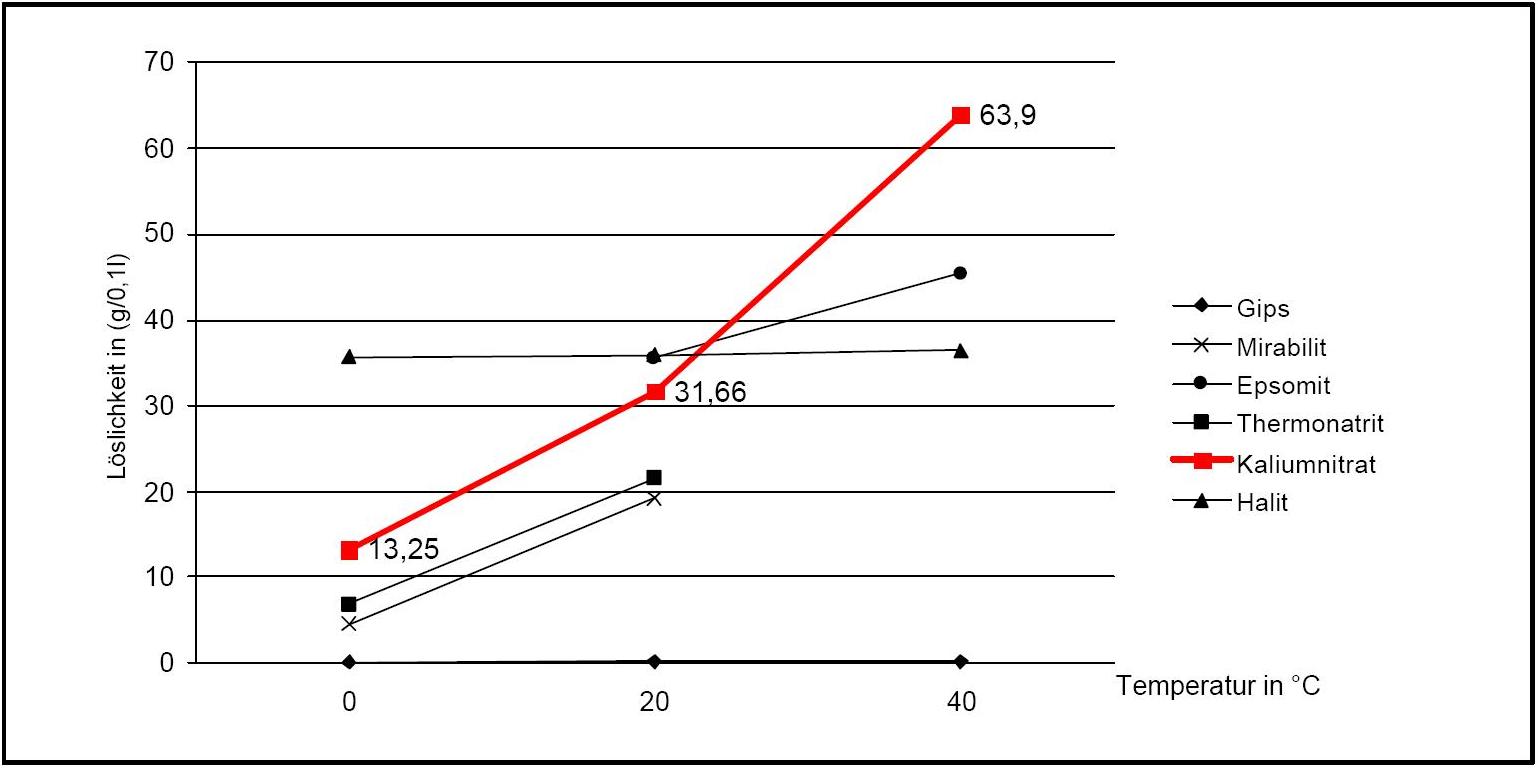
)Potassium nitrate has a high water solubility, belonging to the group of mobile salts. It can be associated with frequent changes in the accumulation zones in the porous material. The temperature effect on the water solubility is strong, which is reflected in the steep curve in Diagram 1.
A consequence of this is the danger of solution supersaturation during rapid temperature drop, and a subsequent crystallization of the salt.
Hygroscopicity[edit]
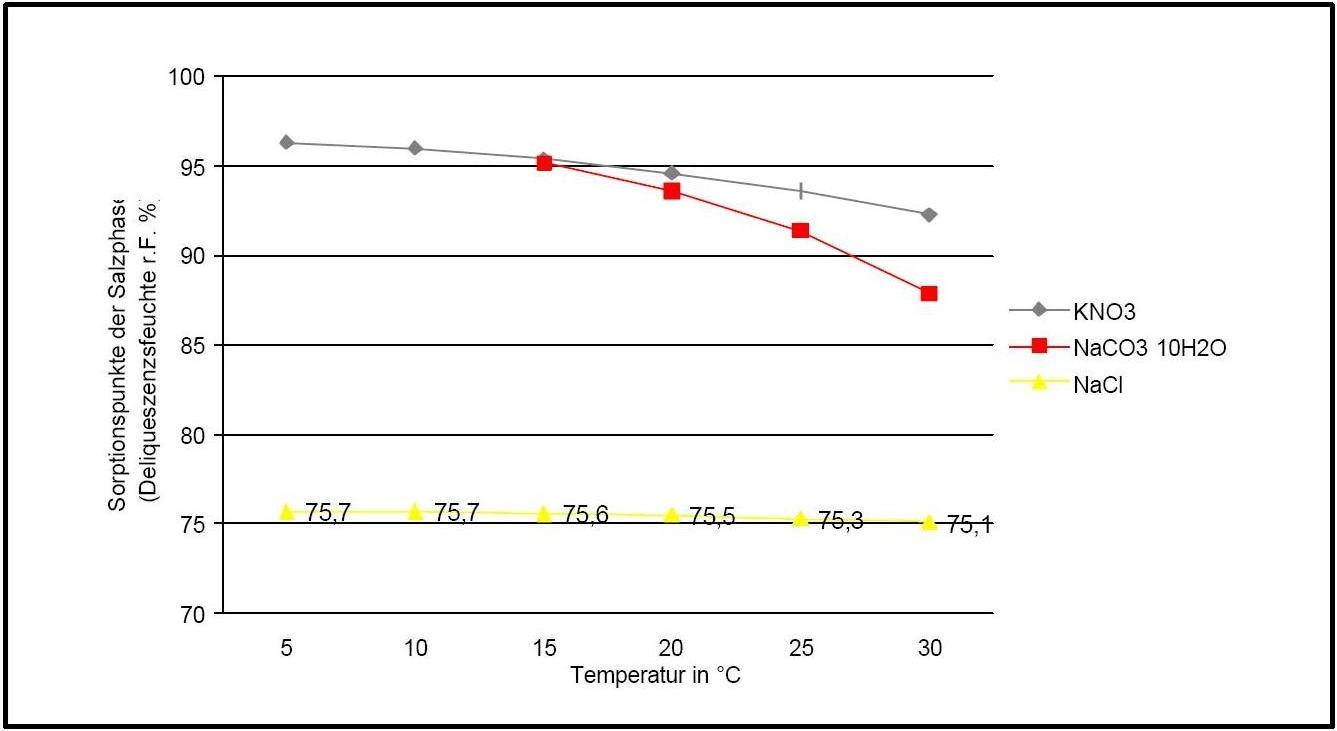
Die Deliqueszenzfeuchte von Kaliumnitrat liegt im Temperaturbereich von 0°C bis 30°C stets über 90% r.F. und ist vergleichsweise linear. Sie wird unter dem Einfluss von Fremdionen allerdings deutlich nach unten verschoben.
| 0°C | 5°C | 10°C | 15°C | 20°C | 25°C | 30°C |
| 96.3%r.F. | 96.3%r.F. | 96%r.F. | 95.4%r.F. | 94.6%r.F. | 93.6%r.F. | 92.3%r.F. |
| MgSO4 | Ca(NO3)2 | Na2SO4 | NaCl | |
| KNO3 | 78% rF | 51% rF | 81% rF | 67% rF |
Feuchtesorption[edit]
Die Feuchtesorption von Kaliumnitrat nach 56 Tagen liegt bei einer Lagerungsfeuchte von 87% r.F . erst bei 6 M% (vgl. Tablle 1). Bei niedrigeren Lagerungsfeuchten von 81% oder 79% konnte keine Feuchtesorption festgestellt werden. Unter gleichen Bedingungen konnte mit einer Mischung (1:1) von Kaliumnitrat und Natriumchlorid eine Feuchtesorption bei 87% r.F. von 221 M%, bei 81% r.F. von 130 M% und bei 79% r.F. von 70 M% gemessen werden.[(vgl. Tabelle 1)
| Storage humidity | 87%r.H. | 81%r.H. | 79%r.H. |
| KNO3 | 6 | 0 | 0 |
| KNO3 + NaCl (1:1 molare Mischung) | 221 | 130 | 70 |
Crystallisation Pressure[edit]
Analytical proof[edit]
Microscopy[edit]
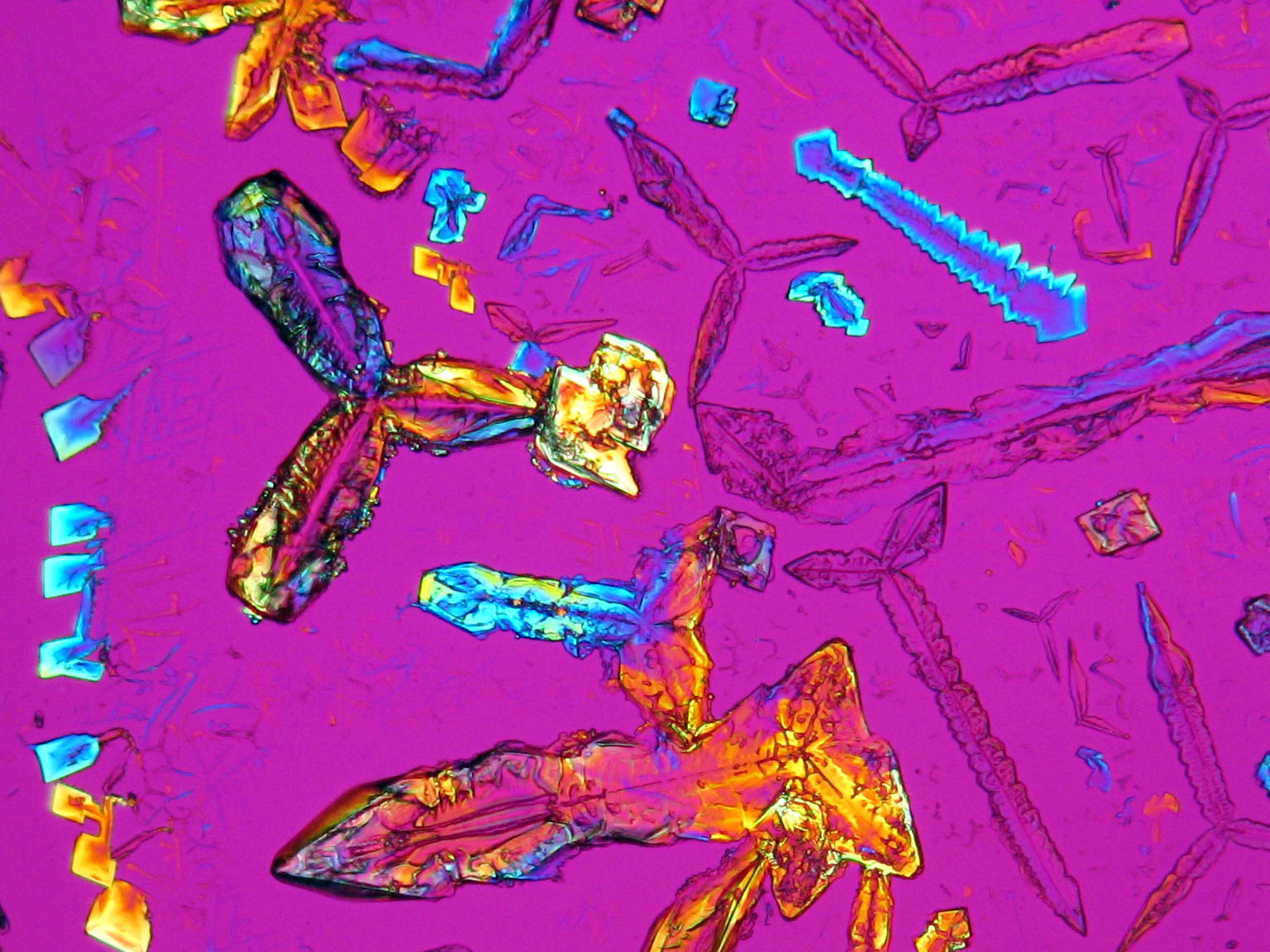
Laboratory Investigations: Bei langsamer Rekristallisation eines überwiegend aus Kaliumnitrat bestehenden Präparates werden tafelig-flache, rhombenförmige Kristalle und lattige oder stäbchenförmige Partikel ausgefällt. Insbesondere zu Beginn der Rekristallisation von Kaliumnitrat aus wässerigen Lösungen wie auch aus Lösungen mit geringem Fremdionenanteil, lässt sich eine charakteristische Bildung rhombenförmiger Kristalle beobachten, die am Lösungstropfenrand entstehen. Unter starkem Einfluss von Fremdionen (bei hoher Fremdionenkonzentration im Ausgangsmaterial) können die oben beschriebenen morphologischen Charakteristika nahezu wegfallen, und es treten unspezifischere Kristallformen des Kaliumnitrates auf. Der pH-Wert von überwiegend kaliumnitrathaltigen Präparaten liegt im neutralen Bereich, die Hygroskopizität ist gering.[Mainusch:2001]Title: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Author: Mainusch, Nils
Refractive indices: nx = 1,335; ny =1.505; nz =1.506
Birefringnece: Δ = max. 0,171
Crystal class: orthorhombic
Investigations with the polarizing microscope
Die Zuweisung der Brechungsindizes von Kaliumnitrat erfolgt entsprechend der Immersionsmethode, wobei die Einbettung in Standard-Immersionsöl mit dem Brechungsindex nD=1,518 bereits alle notwendigen Beobachtungen ermöglicht. Aufgrund der hohen maximalen Doppelbrechung zeigt Kaliumnitrat lebhafte Interferenzfarben. Zur korrekten Zuweisung der höchsten Interferenzfarbe empfiehlt es sich, den Rot I -Kompensator zu benutzen.
Die Auslöschung ist parallel oder symmetrisch. Im Regelfall tritt beim Einschwenken in die Normalstellung an elongierten Kristallen eine gut beobachtbare parallele Auslöschung auf. Symmetrische Auslöschung kann an rhombenförmigen Partikeln beobachtet werden.
Die Abbildungen weiter unten veranschaulichen einen Spezialfall im Auslöschungsverhalten an elongierten Kristallen. Was zunächst als eine schiefe Auslöschung gedeutet werden kann, erweist sich bei detaillierter Betrachtung der Einzelkristalle und der Klärung der tatsächlich vorliegenden Symmetrieebenen als parallele und symmetrische Auslöschung.
Mix up
Potassium nitrate is clearly identifiable. The data in the table below show salts which have refractive indices that are similar to those of potassium nitrate, however, there are clear distinguishing features.
| Salt Phase | Distinguishing Features to Niter |
| Nitronatrite NaNO3 | |
| Nitromagnesite Mg(NO3)2 • 6H2O | inclined extinction/ hygroscopic |
| Nitrocalcite Ca(NO3)2 • 4H20 | significantly lower birefringence/inclined extinction/hygroscopic |
Niter in mixed systems (after ch [Mainusch:2001]Title: Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung
Author: Mainusch, Nils )
)
Im Mischsystem K+-NO32-– Ca2+-SO42- werden aufgrund des hohen Fremdionenanteils stark verwachsene KNO3-Kristalle ausgebildet. Die Tendenz, in großteiligen und länglich geformten Partikeln zu kristallisieren, bleibt beim Kaliumnitrat bestehen. Verfolgt man den Prozess der Rekristallisation, so ist die zeitlich frühere Bildung von Gipskristallen klar nachzuvollziehen. Im vorliegenden, komplexen Mischsystem werden neben Kaliumnitrat und Gips als Hauptkomponenten noch andere Salzphasen wie Kaliumsulfat und Kalium-Calcium-Doppelsalze gebildet (Calciumnitrat konnte nicht festgestellt werden). Der Nachweis aller Salzphasen, die in diesem Mischsystem entstehen können, ist mit einigem Aufwand bei der Trennung und Präparation verbunden. Hilfreich ist es, sich bei der Präparation und der Trennung die Unterschiede der Wasser- und Ethanollöslichkeiten der Salze zunutze zu machen.
Bei der Betrachtung des zweiten Mischsystems (K+-NO32- – Na+- Cl-) zeigt sich, daß der Ausfall von gut ausgebildeten KNO3-Einzelkristallen kurz vor der Bildung isotroper Halitkristalle einsetzt. Dies entspricht den geringfügigen Löslichkeitsunterschieden der beiden Salze. Als Produkte ist es möglich, Kaliumnitrat und Halit nachzuweisen.
X-ray diffraction[edit]
Raman spectroscopy[edit]
DTA: Differential Thermal Analysise"[edit]
IR spectroscopy[edit]
Dealing with damage caused by Niter[edit]
Niter and damages caused by niter in the image[edit]
On objects[edit]
Under the polarizing microscope[edit]
- KNO<sub
Under the scanning electron microscope[edit]
Weblinks[edit]
- ↑ http://webmineral.com/data/Niter.shtml gelesen 28.07.2010
- ↑ http://www.mindat.org/min-2917.html
- ↑ http://www.mineralienatlas.de/lexikon/index.php/MineralData?mineral=Niter
- ↑ http://webmineral.com/jpowd/JPX/jpowd.php?target_file=Niter.jpx; Viewed on 15/04/2011
- ↑ ttp://en.wikipedia.org/wiki/Niter; Viewed on 15/04/2011
- ↑ http://www.galleries.com/minerals/carbonat/niter/niter.htm; Viewed on 15/04/2011
Literature[edit]
| [Mainusch:2001] | Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
| [Robie.etal:1978] | Robie R.A., Hemingway B.S.; Fisher J.A. (1978): Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar pressure and higher temperatures. In: U.S. Geol. Surv. Bull, 1452 () |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (eds.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, 10.1007/978-3-642-45155-3_4. |  |
| [Vogt.etal:1993] | Vogt, R.; Goretzki, Lothar (1993): Der Einfluss hygroskopischer Salze auf die Gleichgewichtsfeuchte und Trocknung anorganischer Baustoffe, unveröffentlichter Bericht. |  |