Salts/Salt Mixtures
Author: Amelie Stahlbuhk
back to SalzWiki:Portal
Abstract[edit]
The key properties of salts and salt mixtures are described by means of phase and solubility diagrams. Mainly those salts relevant to cultural heritage objects are addressed.
Salts in cultural heritage objects[edit]
Salts are based on ionic compounds, having both positively charged ions (cation) and a negatively charged ions (anion. Both cations and anions can have one or more positive or negative charges but they must balance out in salt. Cultural heritage objects of porous, inorganic materials, may be contaminated with salts. The most common cations are sodium (Na+), potassium (K+)), magnesium (Mg++)and calcium (Ca++). For the case of anions, the most frequently found are chloride (Cl-), sulfate (SO4=),nitrate (NO3-)and carbonate(CO3=). Depending on the environment of the object, origin of the salts and past restorations/conservation measure, there may be other cations present, such as barium (Ba++) or ammonium (NH4+), or anions, such as acetate (CH3COO-). The latter one is particularly relevant in the case where objects, such as ceramics, are displayed or stored in wooden cases which emit acetic acid over time, resulting in the efflorescence of an acetate salt, such as sodium or potassium from the object itself. In the case of metal objects, other cations may also appear. The following section will focus mainly on the most common minerals.
Single, double or triple salt[edit]
Salts can be differentiated depending on the number of cations or anions they contain. If there is only one cation and one anion, such as is the case for sodium chloride ([halite], NaCl), then it is a single salt. An example of a double salt could be that of darapskite, which contains only one cation, sodium,but two different anions, sulfate and nitrate(Na3(SO4)(NO3)∙H2O) as well as aphtitalite which has two cations sodium and potassium but only one anion sulfate K3Na(SO4)2).
However, this formula could also be written as follows: Na2SO4∙3K2SO4 or (K3Na(SO4)2), the former showing that the salt is actually composed by a combination of two single salts.
Some double salts may be found on building materials that may form depending on environmental conditions, as well as triple salts; the latter, according to the definition may have three different cations or anions, however, these are not as frequently found.
In the case of double salts, some may differentiate themselves depending on whether they have a congruent or incongruent solubility. In the case of a congruent solubility, when the salt dissolves in water, the solution will have the same mixture of anions and cations as the salt itself, and when it evaporates, the same salt will precipitate out. In the case of incongruent solubility, depending on the concentration of the produced solution, other phases may crystallize out, so that the solution will no longer have the same composition as the original salt so that when the solution evaporates completed, the original salt will not necessarily be obtained, since some phases had separated previously. Hence, the crystallization and dissolution processes of incongruent salts is very complex and information regarding their solubility and crystallization processes is not easily predictable.
Salt solubity[edit]
Salts have distinct solubilities that are temperature dependent. For buildings contaminated by salts this is an important point, since the mobility of a particular salt will depend on its solubility; those with lower solubility will crystallize sooner. Considering a wall with rising damp, where the ground water and the salts is contains rises by capillarity, a fractionation of the salts can be detected. Salts with low solubility will crystallize out close to where the water enters the wall, while highly soluble salts may rise higher [Arnold.etal:1991]Title: Monitoring Wall Paintings Affected by soluble Salts
Author: Arnold, Andreas; Zehnder, Konrad .
.
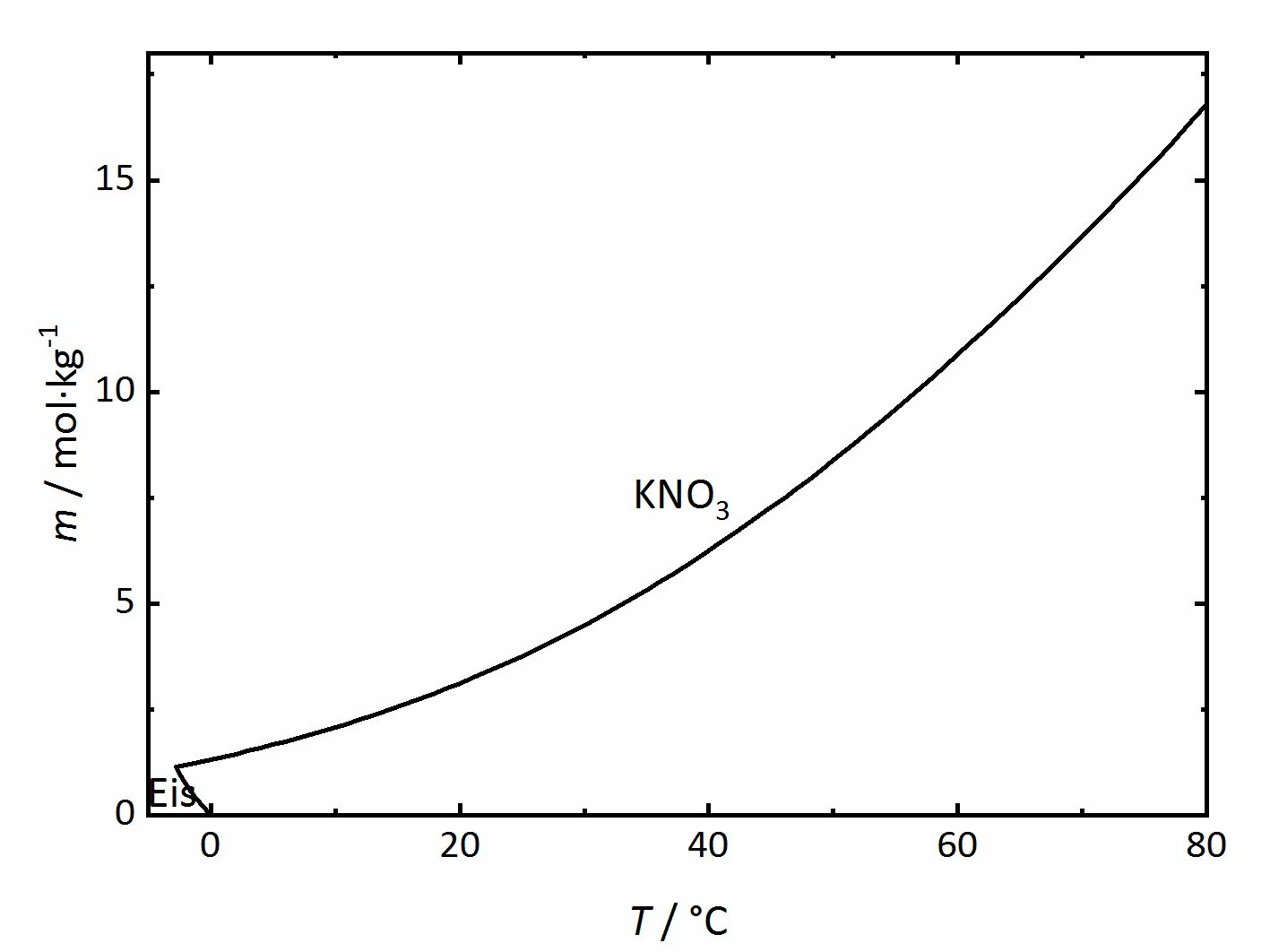
The solubility temperature dependence can be described by solubility diagrams. To illustrate the point the solubility diagram for a single salt, such as potassium nitrate, is shown in Fig. 1. In this diagram, the solubility of the salt in water is given by its concentration expressed in molality (mol/kgsolvent, where the solvent considered here is always water) as the ordinate axis as a function of temperature as the abscissa axis. The black line in the diagram reflects the saturation concentration of the salt as a function of the temperature. At 20°C, the solution of the potassium nitrate would have a molality of 3.1 mol/kg corresponding to a saturated solution. Below the line, the solution is not saturated, above the line the solution is saturated and salt will precipitate out if above that concentration. In the case of this salt, the solubility increases with temperature. At very low temperatures, ice will also crystallize out.
For a given salt, the equilibrium between crystallization and dissolution can be described by the following equation:
Mν,MXν,X•ν0H2O ⇌ νMMzM++νXXzX-+ν0H2O (Eq. 1)
M and X are the cations and anions with their number ν and their charge z while ν0 represents the number of possible water molecules, so that the equation can also be applied to hydrated salts. The corresponding equilibrium constant is the solubility product lnKMX.
lnKMX=νMlnmM+νXlnmX+νMlnγM+νXlnγX+ν0lnaw (Eq. 2)
The molalities are m and the activation coefficient of the cations and anions in a saturated solution of the salt is given by γ while the water activity is given by aw.
aw=RH=pw/pw,0 (Eq. 3)
In the above, the actual water vapor partial pressure is given by pw and the saturation partial pressure is given by pw,0, so that the water activity of a solution that is in equilibrium with the air moisture above the solution.
Hydrated salts[edit]
Some salts may crystallize both as anhydrous as well as hydrated phase with one or more water molecules, the latter being embedded into the crystal structure. Mirabilite Na2SO4∙10H2O forms from the system Na+-SO42--H2O and crystallizes with ten water molecules embedded in the crystal, with a ratio of one mole Na2SO4 to ten moles H2O. A hydration reaction can be postulated similarly to a solubility reaction:
Mν,MXν,X•ν0,AH2O+(ν0,B-ν0,A)H2O(g) ⇌ Mν,MXν,X•ν0,BH2O (Eq. 4)
where ν0,A corresponds to the number of water molecules in the lower hydration phase and ν0,B corresponding to the higher hydration phase. The equilibrium constant for the hydration reaction KH can be formulated as follows:
KH=pw0/pw,AB=1/RHAB (Eq. 5)
The saturation partial pressure, or deliquescence, pw0 will be in equilibrium with the water vapor pressure of the lower (A) and the higher (B) hydration phase pw,AB, from where the reciprocal value of the relative humidity (RH) in equilibrium with both phases, A and B, is given by
RHAB. When the RH increases above that for RHAB hydration of the salt will occur, while if the RH decreases below that value, dehydration will occur. [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja [Steiger:2009a]Title: Modellierung von Phasengleichgewichten
[Steiger:2009a]Title: Modellierung von Phasengleichgewichten
Author: Steiger, Michael .
.
Phase diagrams[edit]
In Salzsystemen der Form Mz+-Xz--H2O (M sind die Kationen und X die Anionen, wobei auch mehrere Ionen vorkommen können, und die Ladung z ebenfalls variieren kann) können in Abhängigkeit der Temperatur und der relativen Luftfeuchtigkeit verschiedene Phasen auftreten. In Phasendiagrammen können thermodynamisch stabile Bedingungen für die verschiedenen Phasen abgeleitet werden.
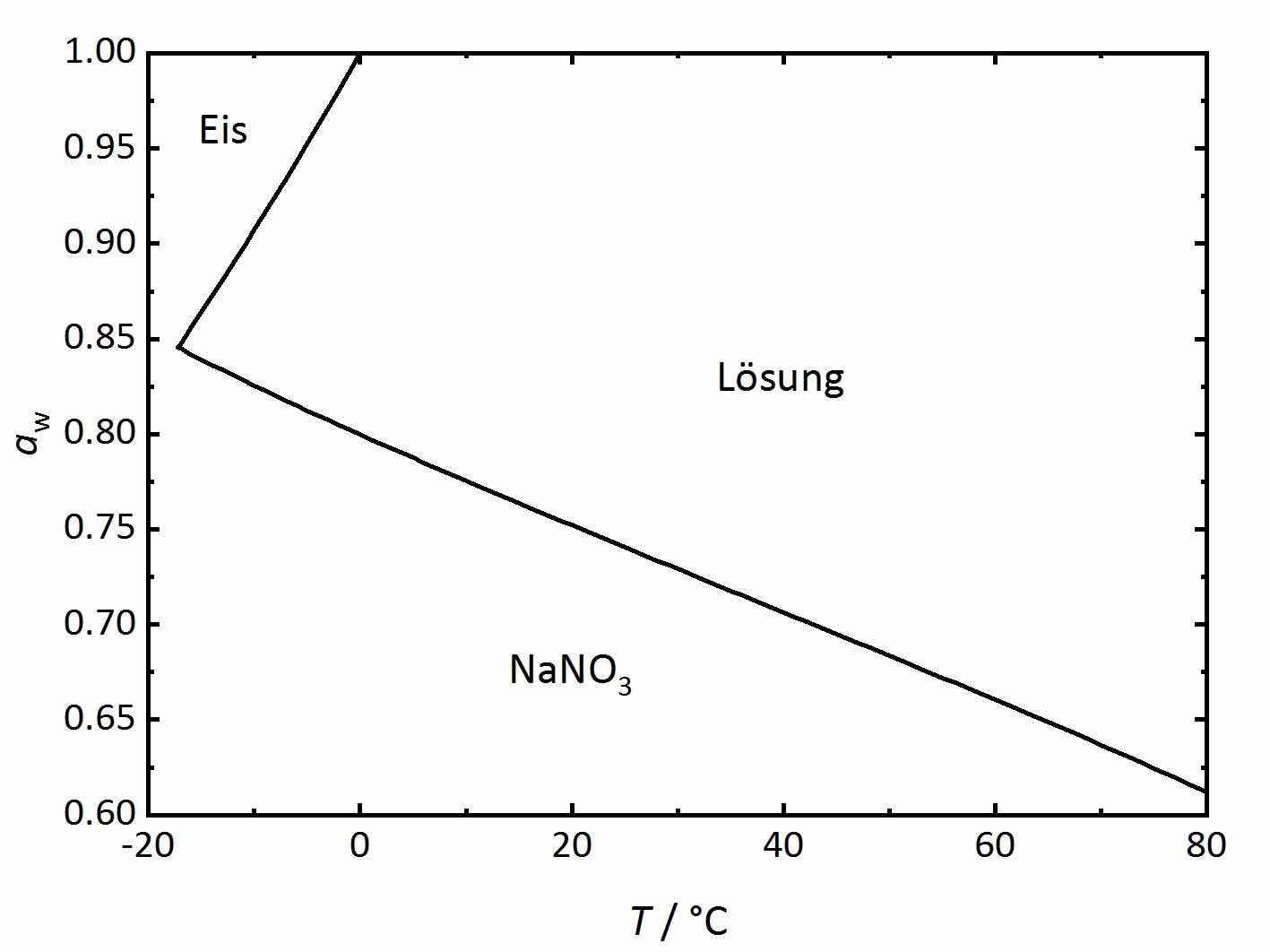
Bei Einzelsalzen, die keine Hydrate bilden, gibt es einen salzspezifischen und temperaturabhängigen Wert der relativen Luftfeuchtigkeit, ab dessen Erreichen das Salz beginnt Wasser in Form von Wasserdampf aus der Umgebung aufzunehmen, um eine gesättigte Lösung zu bilden. Dieser Wert wird als Deliqueszenzfeuchte bezeichnet. An diesem Punkt der gesättigten Lösung liegen die Phasen kristallines Salz, gesättigte Lösung und Wasserdampf der Umgebung im Gleichgewicht vor, so dass die Deliqueszenzfeuchte im Falle von Einzelsalzen der Wasseraktivität der Lösung entspricht. Wird das Phasendiagramm von Natriumnitrat (Abbildung 2) betrachtet, so kann die Deliqueszenzfeuchte bei einer Temperatur von 20 °C anhand der Linie im Diagramm abgelesen werden. Sie liegt demnach bei 75.3 % RH. Im Diagramm kann zudem erkannt werden, dass die Deliqueszenzfeuchte mit zunehmender Temperatur sinkt. Oberhalb der Linie liegt eine Lösung vor, die mit zunehmender relativer Luftfeuchtigkeit bei gegebener Temperatur durch fortschreitende Aufnahme von Wasserdampf aus der Umgebung weiter verdünnt wird. Bei sinkender Feuchte konzentriert sich die Lösung weiter auf, da Wasserdampf an die Umgebung abgegeben wird, bis das Salz bei der Deliqueszenzfeuchte wieder ausfällt und unterhalb dieser nur noch das kristalline Salz vorliegt. Wieviel Wasser oberhalb der Deliqueszenzfeuchte aufgenommen wird, wird durch das Gleichgewicht zwischen Lösung und Wasserdampf der Umgebung, also der gegebenen relativen Luftfeuchtigkeit bestimmt. Herrscht Gleichgewicht, so entspricht die Wasseraktivität der Salzlösung der relativen Feuchte der Umgebung (Gleichung 3). Wird das Gleichgewicht durch Änderung der Feuchte verlassen, wird solange Wasserdampf aus der Umgebung aufgenommen beziehungsweise an sie abgegeben, bis das neue Gleichgewicht erreicht ist.
Author: Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas

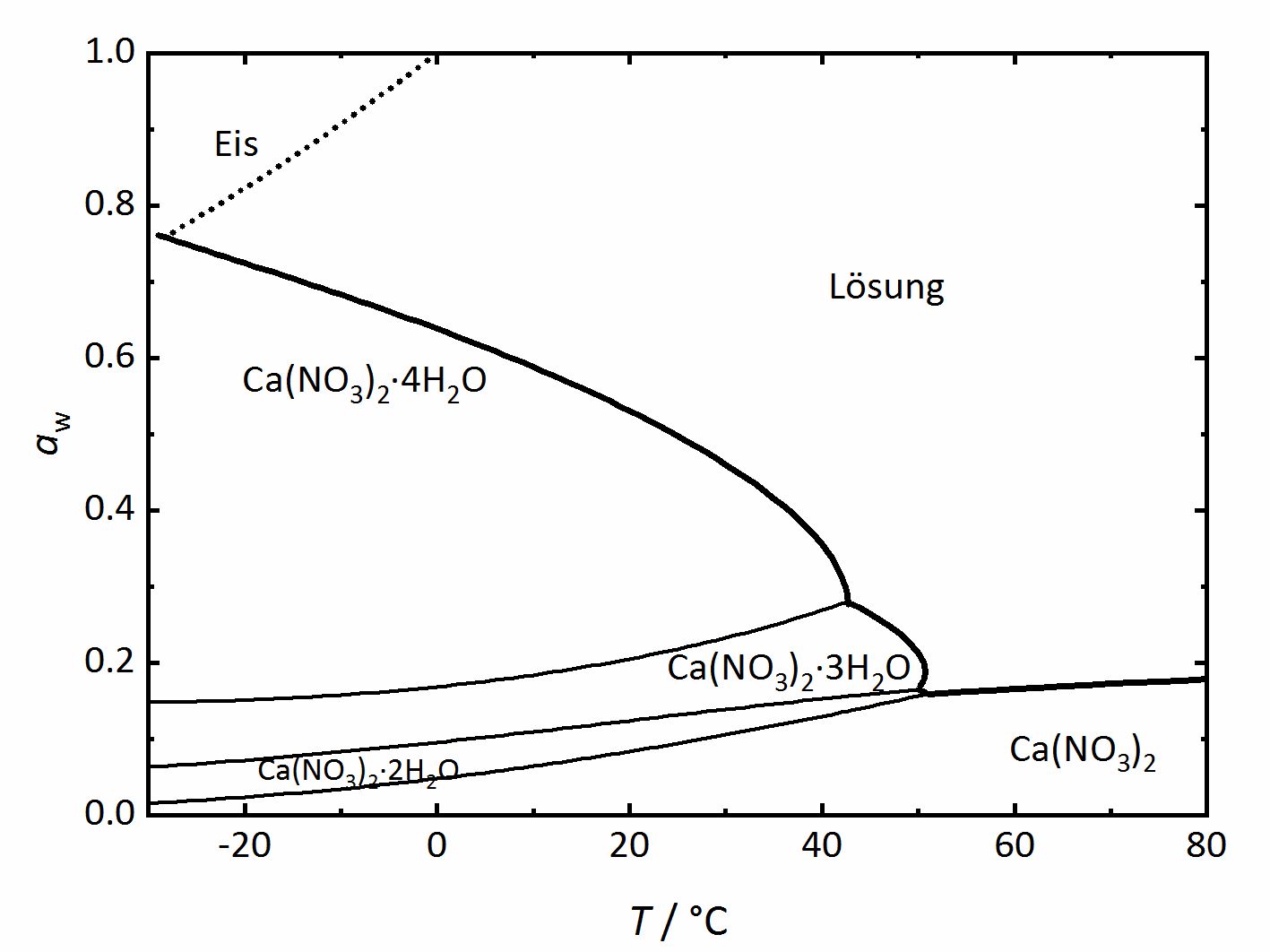
Neben einfachen Einzelsalzen, gibt es auch eine Vielzahl an Salzen, die in verschiedenen Hydratphasen vorliegen. Ein recht einfaches Phasendiagramm für ein Salzsystem mit mehreren möglichen Hydratstufen ist das des Systems Ca2+-NO3--H2O (Abbildung 3). In diesem System können vier verschiedene Hydratstufen auftreten. Ähnlich wie die Deliqueszenzfeuchte den Wert angibt, an dem ein kristallines Salz Wasserdampf aufnimmt und eine gesättigte Lösung bildet, gibt es auch einen Wert der Feuchte, bei dem eine wasserfreie oder geringer hydratisierte Phase Wasserdampf aus der Umgebung aufnimmt, um die höher hydratisierte Phase zu bilden. In einem Phasendiagramm eines Salzsystems mit verschiedenen Hydratstufen gibt es wie auch im Diagramm eines Einzelsalzes Linien für die Deliqueszenzfeuchte, welches die dickeren, am weitesten oben verlaufenden Linien sind. Auch hier beschreibt sie das Gleichgewicht zwischen kristallinem Salz, gesättigter Lösung und Wasserdampf in der Luft. Zusätzlich befinden sich aber noch weitere Linien im Diagramm, die andere Phasenübergänge beschreiben und als dünnere Linien dargestellt sind. Sie repräsentieren Dehydratations- beziehungsweise Hydratationsgleichgewichte zwischen einer geringer und einer höher hydratisierten Phase. Bei Bedingungen, die auf der Linie liegen, liegen beide Phasen gemeinsam vor, darüber die jeweils höher hydratisierte Form, darunter die jeweils geringer hydratisierte Form. Zusätzlich zu den eben genannten Phasenübergängen muss bei sehr geringen Temperaturen auch die Eisbildung berücksichtigt werden, so dass die gepunktete Linie die Gefrierpunkte angibt. Somit kann eine Lösung bei Temperaturen unterhalb von 0 °C sowohl im Gleichgewicht mit Eis als auch mit dem Calciumnitrat-Tetrahydrat (Nitrocalcit) vorliegen [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
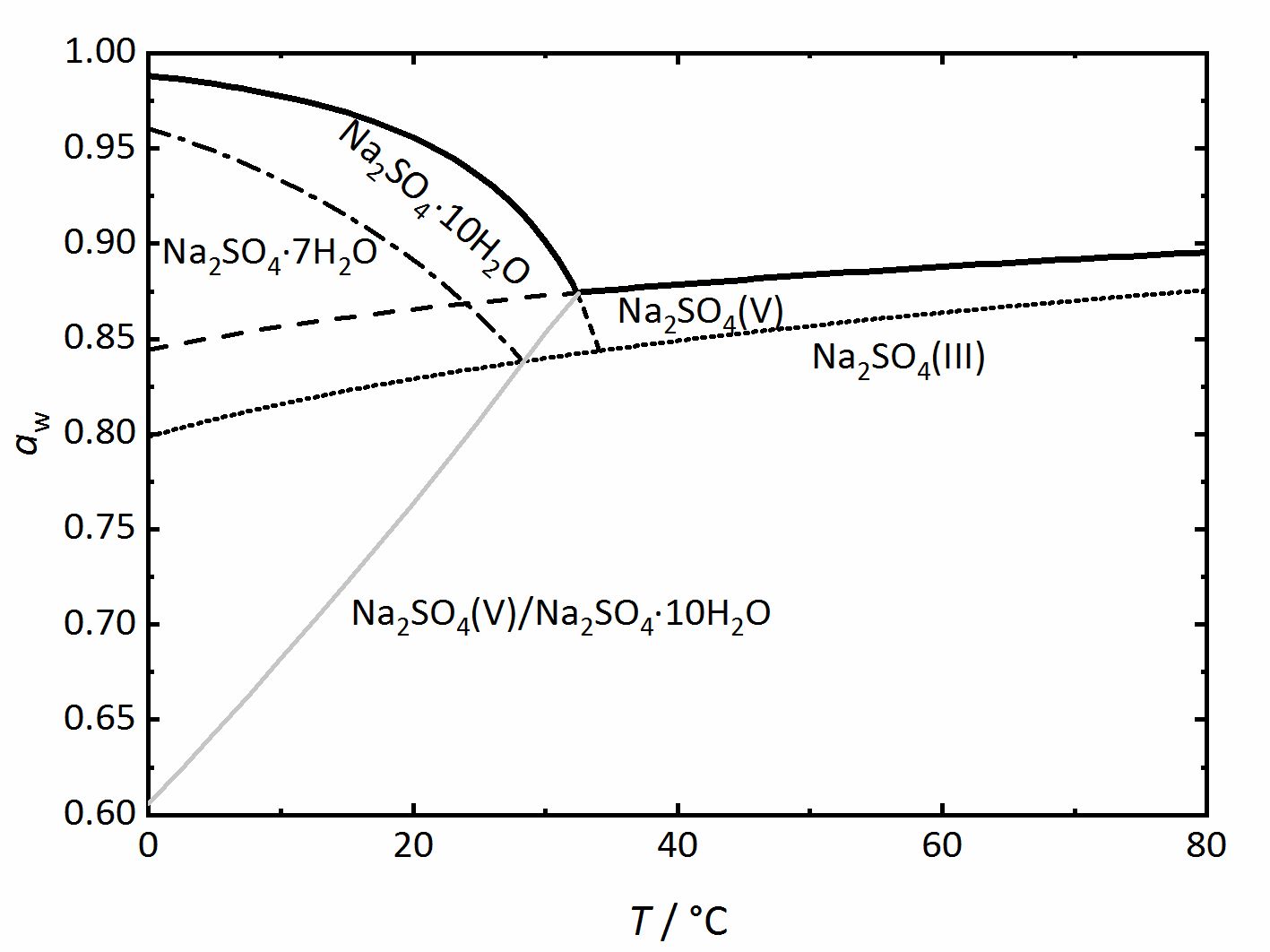
Da die Phasendiagramme von Salzsystemen mit Hydratstufen auch noch komplexer sein können, soll auch auf das System Na+-SO42--H2O [Steiger.etal:2008]Title: Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4–H2O and the generation of stress
Author: Steiger, Michael; Asmussen, Sönke eigegangen werden (Abbildung 4). Auch hier kennzeichnen die am weitesten oben verlaufenden, dickeren Linien das Gleichgewicht zwischen einer gesättigten Lösung und dem kristallinen Salz und somit die Deliqueszenzfeuchte. Die graue Linie repräsentiert das Dehydratations- beziehungsweise das Hydratationsgleichgewicht zwischen der wasserfreien Phase (Thenardit) und dem Decahydrat (Mirabilit). Mirabilit und Thenardit sind nicht bei allen Temperaturen stabil, so dass im Diagramm auch eine Umwandlungstemperatur bei 32.4 °C erkennbar ist. Oberhalb dieser ist Mirabilit keine stabile Phase mehr, darunter ist Thenardit thermodynamisch nicht mehr stabil. Die Linien dieser beiden Salze sind allerdings auch unterhalb (im Falle des Thenardits) beziehungsweise oberhalb (im Falle der Mirabilits) der Umwandlungstemperatur gezeigt, in diesen Bereichen jedoch nur als gestrichelte Linien. Zusätzlich sind weitere gestrichelt beziehungsweise gepunktet dargestellte Linien zu sehen, Phasengrenzen zwischen Natriumsulfat-Heptahydrat beziehungsweise Natriumsulfat Phase III (eine wasserfreie Phase) und den oben bereits erläuterten Phasen. Diese Linien stellen einen Unterschied zu den zuvor vorgestellten Diagrammen dar. Sie repräsentieren metastabile Phasen oder Bereiche. Das bedeutet, dass die Phasen zwar thermodynamisch nicht stabil sind, sie sich aus kinetischen Gründen aber trotzdem bilden können. Bezüglich des Heptahydrats und der Phase III gibt es mehrere Belege, dass sie sich unter bestimmten Bedingungen des Abkühlens oder Eindampfens von Lösungen bilden können, auch wenn Thenardit oder Mirabilit die thermodynamisch stabilen Phasen bilden würden (z.B. [Espinosa.etal:2008]Title: Model for the mechanical stress due to the salt crystallization in porous materials
eigegangen werden (Abbildung 4). Auch hier kennzeichnen die am weitesten oben verlaufenden, dickeren Linien das Gleichgewicht zwischen einer gesättigten Lösung und dem kristallinen Salz und somit die Deliqueszenzfeuchte. Die graue Linie repräsentiert das Dehydratations- beziehungsweise das Hydratationsgleichgewicht zwischen der wasserfreien Phase (Thenardit) und dem Decahydrat (Mirabilit). Mirabilit und Thenardit sind nicht bei allen Temperaturen stabil, so dass im Diagramm auch eine Umwandlungstemperatur bei 32.4 °C erkennbar ist. Oberhalb dieser ist Mirabilit keine stabile Phase mehr, darunter ist Thenardit thermodynamisch nicht mehr stabil. Die Linien dieser beiden Salze sind allerdings auch unterhalb (im Falle des Thenardits) beziehungsweise oberhalb (im Falle der Mirabilits) der Umwandlungstemperatur gezeigt, in diesen Bereichen jedoch nur als gestrichelte Linien. Zusätzlich sind weitere gestrichelt beziehungsweise gepunktet dargestellte Linien zu sehen, Phasengrenzen zwischen Natriumsulfat-Heptahydrat beziehungsweise Natriumsulfat Phase III (eine wasserfreie Phase) und den oben bereits erläuterten Phasen. Diese Linien stellen einen Unterschied zu den zuvor vorgestellten Diagrammen dar. Sie repräsentieren metastabile Phasen oder Bereiche. Das bedeutet, dass die Phasen zwar thermodynamisch nicht stabil sind, sie sich aus kinetischen Gründen aber trotzdem bilden können. Bezüglich des Heptahydrats und der Phase III gibt es mehrere Belege, dass sie sich unter bestimmten Bedingungen des Abkühlens oder Eindampfens von Lösungen bilden können, auch wenn Thenardit oder Mirabilit die thermodynamisch stabilen Phasen bilden würden (z.B. [Espinosa.etal:2008]Title: Model for the mechanical stress due to the salt crystallization in porous materials
Author: Espinosa, R.; Franke, L.; Deckelmann, G. [Genkinger.etal:2007]Title: Crystallisation of sodium sulfate: supersaturation and metastable phases
[Genkinger.etal:2007]Title: Crystallisation of sodium sulfate: supersaturation and metastable phases
Author: Genkinger, Selma; Putnis, Andrew [Grossi.etal:2013]Title: Acoustic emission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones
[Grossi.etal:2013]Title: Acoustic emission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones
Author: Grossi, C.M.; Esbert, R.M.; Suarez del Rio, L.M.; Montoto, M.; Laurenzi-Tabasso, M. [Linnow.etal:2006]Title: Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction
[Linnow.etal:2006]Title: Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction
Author: Linnow, Kirsten; Zeunert, Anke; Steiger, Michael [Xu.etal:1999]Title: In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.
[Xu.etal:1999]Title: In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.
Author: Xu B., Schweiger G. ). Metastabile Phasen sind somit auch unter realen Bedingungen relevant und sollten nicht vernachlässigt werden.
). Metastabile Phasen sind somit auch unter realen Bedingungen relevant und sollten nicht vernachlässigt werden.
Author: Steiger, Michael; Asmussen, Sönke

In Bezug auf stark hygroskopische Salze wie Calciumnitrat oder Calciumchlorid liegen in den Phasendiagrammen zwar keine Phasengrenzen für mögliche metastabile Phasen vor, jedoch sind metastabile Zustände bei diesen Salzen trotzdem relevant. Die Phasengrenze des Gleichgewichts zwischen Lösung und kristallinem Salz gibt zwar aus thermodynamischer Sicht den Punkt an, bei dem das Salz auskristallisieren müsste, um eine gesättigte Lösung zu bilden. Da einige dieser Salzlösungen jedoch teilweise stark übersättigen können, kann die Lösung auch unterhalb der Deliqueszenzfeuchte als metastabiler Zustand vorliegen [Steiger:2009a]Title: Modellierung von Phasengleichgewichten
Author: Steiger, Michael .
.
Salt mixtures[edit]
In den meisten realen Objekten des kulturellen Erbes liegen Gemische mehrerer Ionen und somit auch mehrerer Salze vor, wodurch ihre Betrachtung komplizierter wird. Eine Vorhersage über ihr Verhalten unter bestimmten klimatischen Bedingungen ist nicht mehr so einfach möglich wie für Einzelsalze, bei denen Werte für die Deliqueszenzfeuchte und Hydratationsgleichgewichte aus den Phasendiagrammen abgelesen werden können. Die verschiedenen Salze im Gemisch beeinflussen sich im Hinblick auf ihre Löslichkeiten gegenseitig, so dass Charakteristika wie die Sättigungsfeuchten der Einzelsalze nicht mehr gegeben sind. Somit kann dann bei einer gegebenen Temperatur beispielsweise nicht mehr anhand eines spezifischen Werts abgelesen werden, ab wann das Salz Wasserdampf aus der Umgebung aufnimmt. Bei Salzmischungen muss ein Bereich der klimatischen Bedingungen berücksichtigt werden, in welchem verschiedene Phasen aus dem Gemisch auskristallisieren können. Der Einfluss weiterer Salze auf ein vorliegendes Salz der Form Mν,MXν,X∙nH2O kann anhand des thermodynamischen Löslichkeitsprodukts (Gleichung 2) verdeutlicht werden:
Durch ein weiteres Salz wird die Löslichkeit sowohl beeinflusst, wenn ein gleichioniger Zusatz vorliegt (dann wird mM beziehungsweise mX verändert), als auch wenn dies nicht zutrifft (dann werden trotzdem γM und γX beeinflusst) [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
Im Folgenden soll je ein Beispiel für einen gleich- und einen fremdionigen Zusatz gezeigt werden.
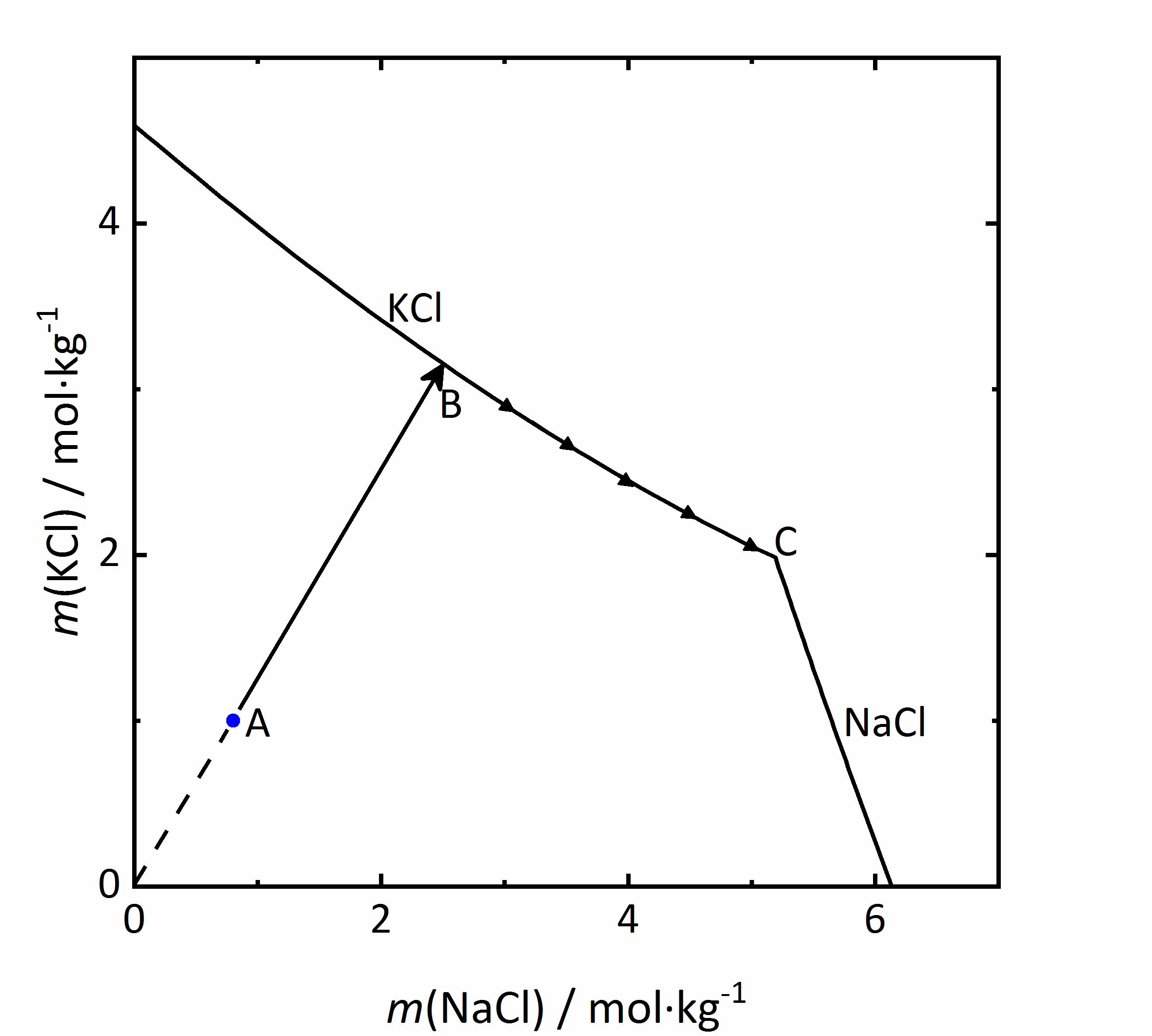
Als Beispiel für einen gleichionigen Zusatz soll das System KCl-NaCl-H2O betrachtet werden. Im Diagramm in Abbildung 5 sind die Molalitäten von KCl gegen die von NaCl aufgetragen. Durch das Vorliegen von Chlorid-Ionen in beiden Salzen, wird mX der Salze (s. Gleichung 1) beeinflusst. Steigt die Konzentration des jeweils anderen Salzes und damit die Chlorid-Konzentration im Gemisch, so nimmt die Löslichkeit des betrachteten Salzes ab. Wird eine Lösung der Zusammensetzung des Punktes A im Diagramm betrachtet, so würde sich die Lösung bei der Verdunstung von Wasserdampf aus der Lösung entlang der Linie AB aufkonzentrieren. An Punkt B wäre Sättigung in Bezug auf KCl erreicht, so dass zunächst dieses Salz aus dem Gemisch auskristallisiert. Da sich die Lösungszusammensetzung durch weitere Verdunstung und durch die Kristallisation von Kaliumchlorid weiter verändert, ist der Kristallisationsverlauf am Punkt B noch nicht abgeschlossen. Im Folgenden kristallisiert KCl entlang seiner Löslichkeitskurve weiter aus, wodurch die Kaliumkonzentration abnimmt, Natriumchlorid sich aber durch die weitere Verdunstung weiter aufkonzentriert. Der Endpunkt C der Kristallisation ist erreicht, wenn Sättigung auch in Bezug auf NaCl erreicht ist, so dass eine dann fortschreitende Verdunstung zur vollständigen Trocknung und Kristallisation beider Phasen führen würde [Steiger:2009a]Title: Modellierung von Phasengleichgewichten
Author: Steiger, Michael .
.
Author: Steiger, Michael
 .
.
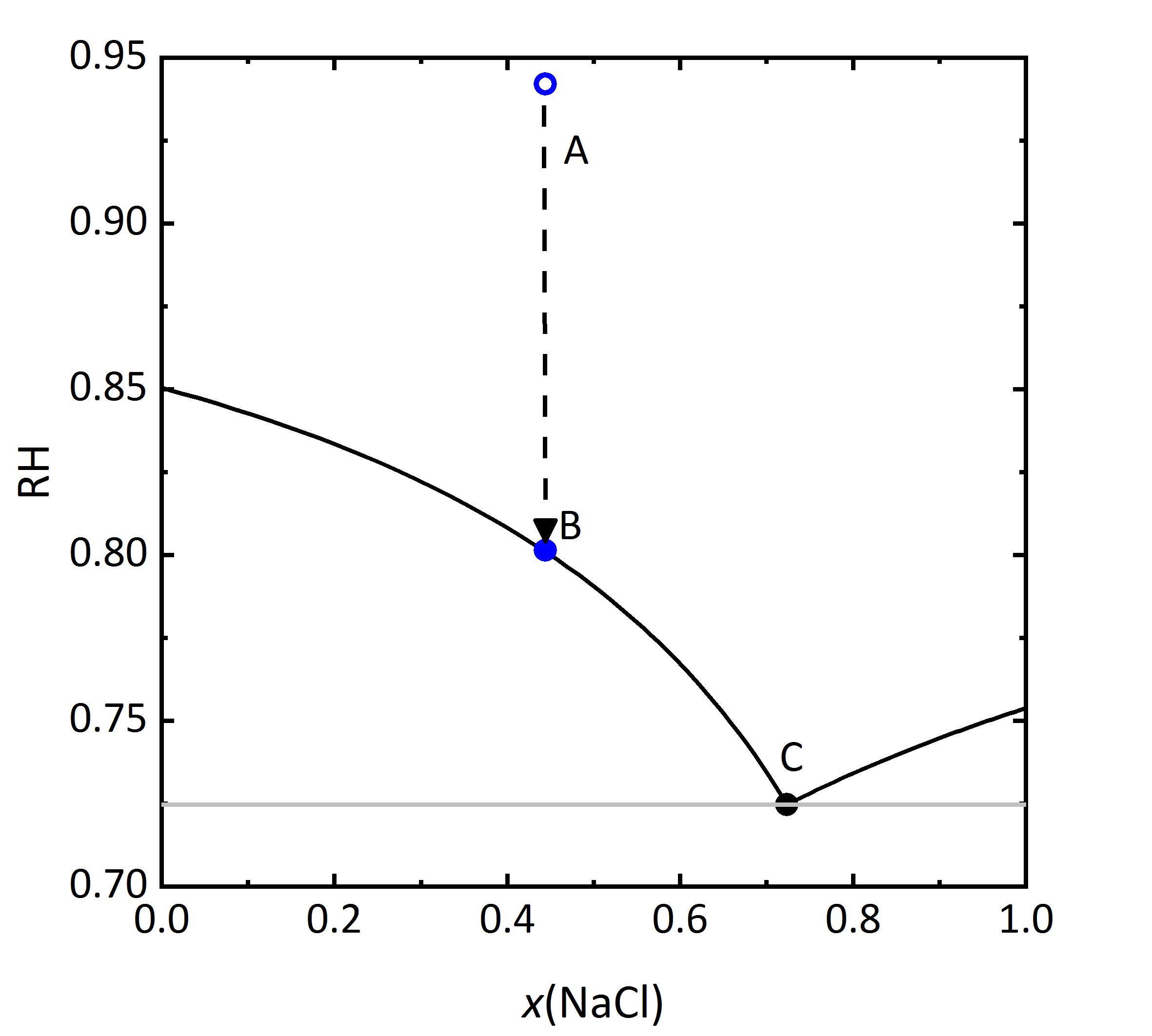
Dass in Salzmischungen auch die Sättigungsfeuchten beeinflusst werden, zeigt das folgende Diagramm in Abbildung 6, in dem die Gleichgewichtsfeuchten der jeweiligen gesättigten Lösungen gezeigt sind. In dem Diagramm ist die relative Luftfeuchtigkeit gegen die Lösungszusammensetzung aufgetragen. Die Lösungszusammensetzung wiederum wird in diesem Falle als Stoffmengenanteil der Natriumchlorid-Konzentration angegeben. Als Stoffmengenanteil wird die Menge einer Komponente des Gemischs in Mol in Bezug auf die Gesamtmenge aller Komponenten bezeichnet. Bei kleinen Stoffmengenanteilen überwiegt demnach Kaliumchlorid in dem Gemisch, bei einem Anteil von 0.5 liegen gleiche molale Mengen Kalium- und Natriumchlorid vor. Wird auch bei diesem Diagramm die Mischung der Zusammensetzung A betrachtet, entspricht die relative Feuchte, die mit dieser Lösung im Gleichgewicht steht 94.2 % RH. Verdunstet Wasser aus der Lösung, wird bei Punkt B Sättigung in Bezug auf KCl erreicht, die relative Luftfeuchtigkeit, die an diesem Punkt mit der gesättigten Lösung und dem kristallinen Salz im Gleichgewicht steht, beträgt 80.1 % RH. Die eigentliche Deliqueszenzfeuchte von KCl beträgt bei 20 °C 85 % RH, so dass die Kristallisation im Gemisch erst bei niedrigeren Feuchten einsetzt. Diese kann auch wie bei der zur Lösung gehörenden Feuchte als Gleichgewichtsfeuchte bezeichnet werden, aber auch als Sättigungsfeuchte des Punktes B. Wird die relative Luftfeuchte weiter gesenkt, kommt es bei 72.5 % RH zum Kristallisationsendpunkt. Wird im Vergleich zu den Punkten A, B und C auf analoge Weise von einem Punkt der Lösungszusammensetzung bei Stoffmengenanteilen >0.73 von Natriumchlorid ausgegangen, zeigt sich, dass auch in diesem Fall die Kristallisation von zuerst gebildetem Natriumchlorid bei geringerer Luftfeuchtigkeit erfolgt als es die Deliqueszenzfeuchte des Einzelsalzes vermuten lassen würde. Das Diagramm verdeutlich auch, dass ein einzelner (kritischer) Wert, bei dem die Kristallisation des Salzes erfolgt, im Falle von Gemischen nicht ausreichend ist. Hier muss vielmehr ein Bereich der relativen Feuchte betrachtet werden, in welchem die Kristallisation kontinuierlich voranschreitet [Steiger.etal:1996]Title: Crystallization properties of salt mixtures: Comparison of experimental results and model calculations
Author: Steiger, Michael; Zeunert, Anke [Price.etal:1994]Title: Preventing salt damage in porous materials
[Price.etal:1994]Title: Preventing salt damage in porous materials
Author: Price, Clifford A.; Brimblecomb, Peter [Steiger.etal:1995]Title: Hygroskopische Eigenschaften und Kristallisationsverhalten von Salzgemischen
[Steiger.etal:1995]Title: Hygroskopische Eigenschaften und Kristallisationsverhalten von Salzgemischen
Author: Steiger, Michael; Dannecker, Walter . Die obere Grenze des Bereichs der relativen Feuchte wird durch die ursprüngliche Zusammensetzung des Gemischs bestimmt. Die untere Grenze der relativen Feuchte liegt am Kristallisationsendpunkt vor, an dem beide Phasen in fester Form gemeinsam existieren. Der Wert der unteren Grenze wird auch als gemeinsame Deliqueszenzfeuchte (engl.: mutual deliquescence humidity; MDRH) beschrieben, da sie den Wert der relativen Feuchte angibt, bei der eine gemischte Lösung im Gleichgewicht mit den weiteren kristallinen Salzen des Gemischs vorliegen kann [Steiger.etal:2014]Title: Weathering and Deterioration
. Die obere Grenze des Bereichs der relativen Feuchte wird durch die ursprüngliche Zusammensetzung des Gemischs bestimmt. Die untere Grenze der relativen Feuchte liegt am Kristallisationsendpunkt vor, an dem beide Phasen in fester Form gemeinsam existieren. Der Wert der unteren Grenze wird auch als gemeinsame Deliqueszenzfeuchte (engl.: mutual deliquescence humidity; MDRH) beschrieben, da sie den Wert der relativen Feuchte angibt, bei der eine gemischte Lösung im Gleichgewicht mit den weiteren kristallinen Salzen des Gemischs vorliegen kann [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
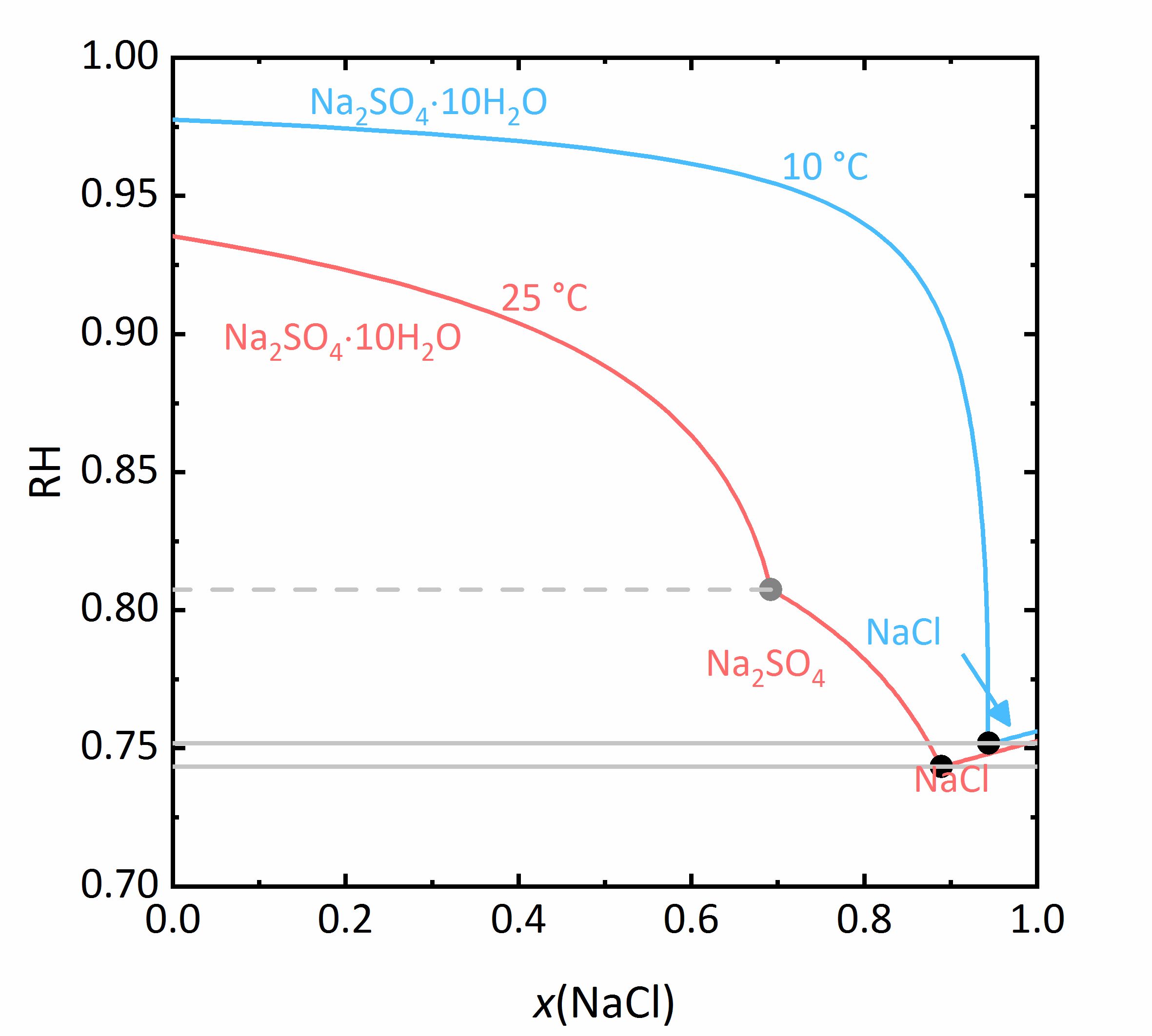
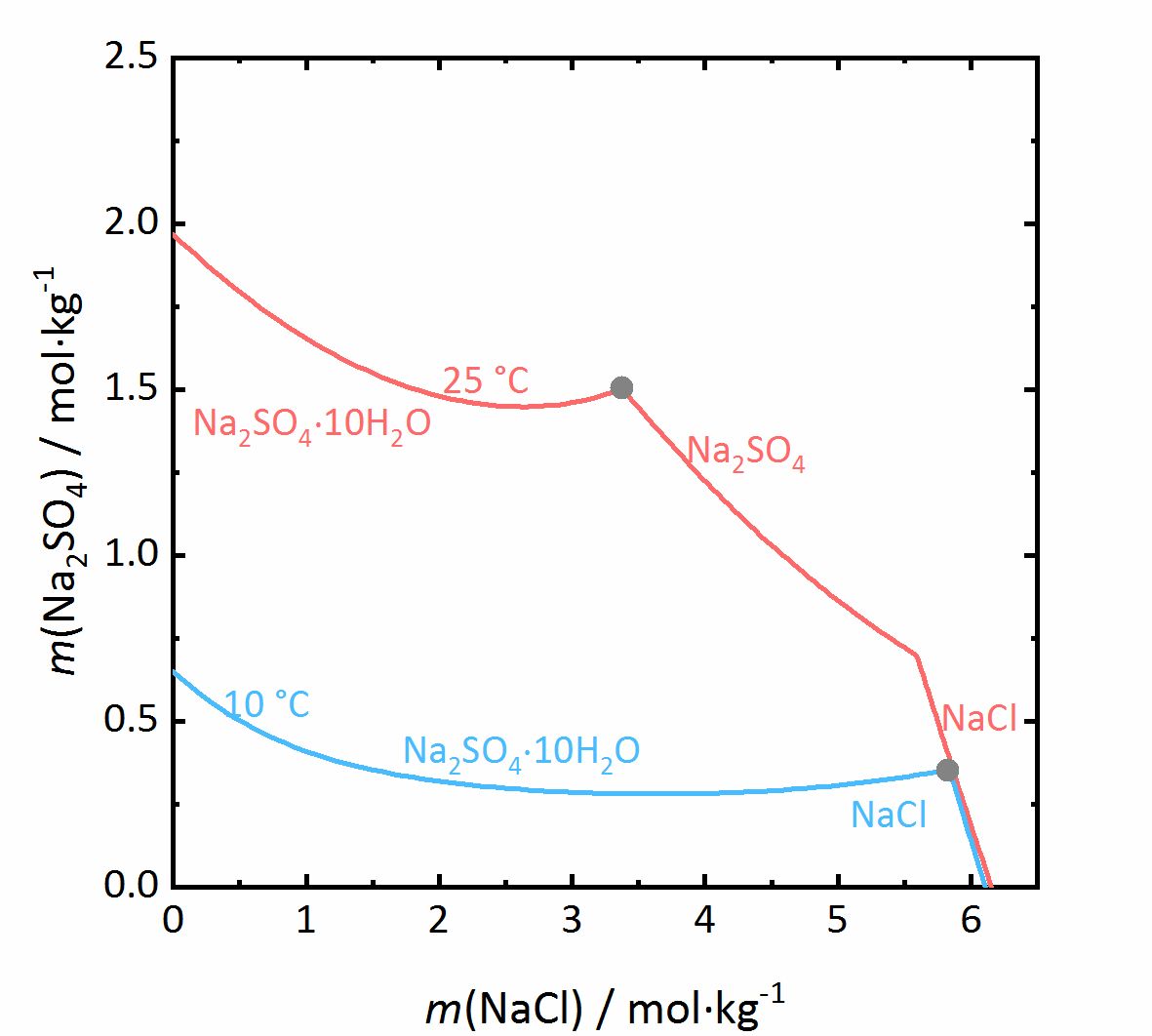
In dem nächsten Beispiel wird das Verhalten der Salzmischungen noch etwas komplizierter. Liegen in einem Gemisch auch Salze vor, die in verschiedenen Hydratstufen vorkommen können, wird nicht nur der Aktivitätskoeffizient beeinflusst, sondern auch die Wasseraktivität. Bei dem Gemisch NaCl-Na2SO4-H2O in Abbildung 7 nimmt die Löslichkeit von Mirabilit trotz eines gleichionigen Zusatzes bei hohen Konzentrationen von Natriumchlorid nochmal zu. Da die Wasseraktivität der Lösung bei steigender Konzentration (also Verdunstung von Wasser) sinkt, erhöht sich die Löslichkeit der Hydratsalze nach einem vorübergehenden Abfall, was am Beispiel des Löslichkeitsdiagramms bei 10 °C verdeutlicht wird. Da das Thenardit-Mirabilit-Dehydratationsgleichgewicht stark temperaturabhängig ist und zudem auch von der Wasseraktivität abhängt, gilt dieses Verhalten jedoch nur bei Temperaturen unterhalb von 18 °C. Liegen höhere Temperaturen vor, so kommt es bei der Kristallisation aus einer solchen gemischten Salzlösung zur Dehydratation des Mirabilits. Unterhalb dieser Temperatur kann die Umwandlung nicht erfolgen, da die relative Feuchte für die Dehydratation (graue Linie im Phasendiagramm von Na2SO4 in Abbildung 4, für die Mischung bei 25 °C graue gestrichelte Linie in Abbildung 8) dann unterhalb der Deliqueszenzfeuchte des Gemischs (jeweils graue Linien in Abbildung 8) liegt. Erst wenn die Gleichgewichtsfeuchte der Umwandlung die Deliqueszenzfeuchte übertrifft, kann Dehydration oder Hydratation in Gegenwart einer Lösung erfolgen. Durch den Zusammenhang der Wasseraktivität mit dem Dehydratationsgleichgewicht kann die Dehydratation von Mirabilit bei Anwesenheit anderer Salze schon bei niedrigeren Temperaturen stattfinden, bei denen Thenardit im reinen Na+-SO42--H2O System im Beisein einer Lösung thermodynamisch nicht stabil wäre. Für reale Objekte kann dies einen wichtiger Aspekt darstellen, da die Hydratation in Anwesenheit einer Lösung weniger erschwert wird. Dadurch können Hydratationsreaktionen schneller ausgelöst werden als bei einer Hydratation ausgelöst durch Wasserdampf, wodurch mögliche Schädigungen des Materials verstärkt werden können. Eine solche Gefahr liegt besonders dann vor, je hygroskopischer das weitere Salz im Gemisch ist, da die Deliqueszenzfeuchte des Gemischs dann geringere Werte annimmt, und die Gleichgewichtsfeuchte der Mirabilit-Thenardit-Umwandlung häufiger darüber liegt. Zu beachten ist, dass die Werte der Gleichgewichtsfeuchte für die Umwandlung durch andere Salze nicht beeinflusst werden. Ausschlaggebend ist lediglich, ob die Werte der Umwandlung oberhalb oder unterhalb der Deliqueszenzfeuchte des Gemischs liegen [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja
 .
.
Salt mixtures in which a double salt may form[edit]
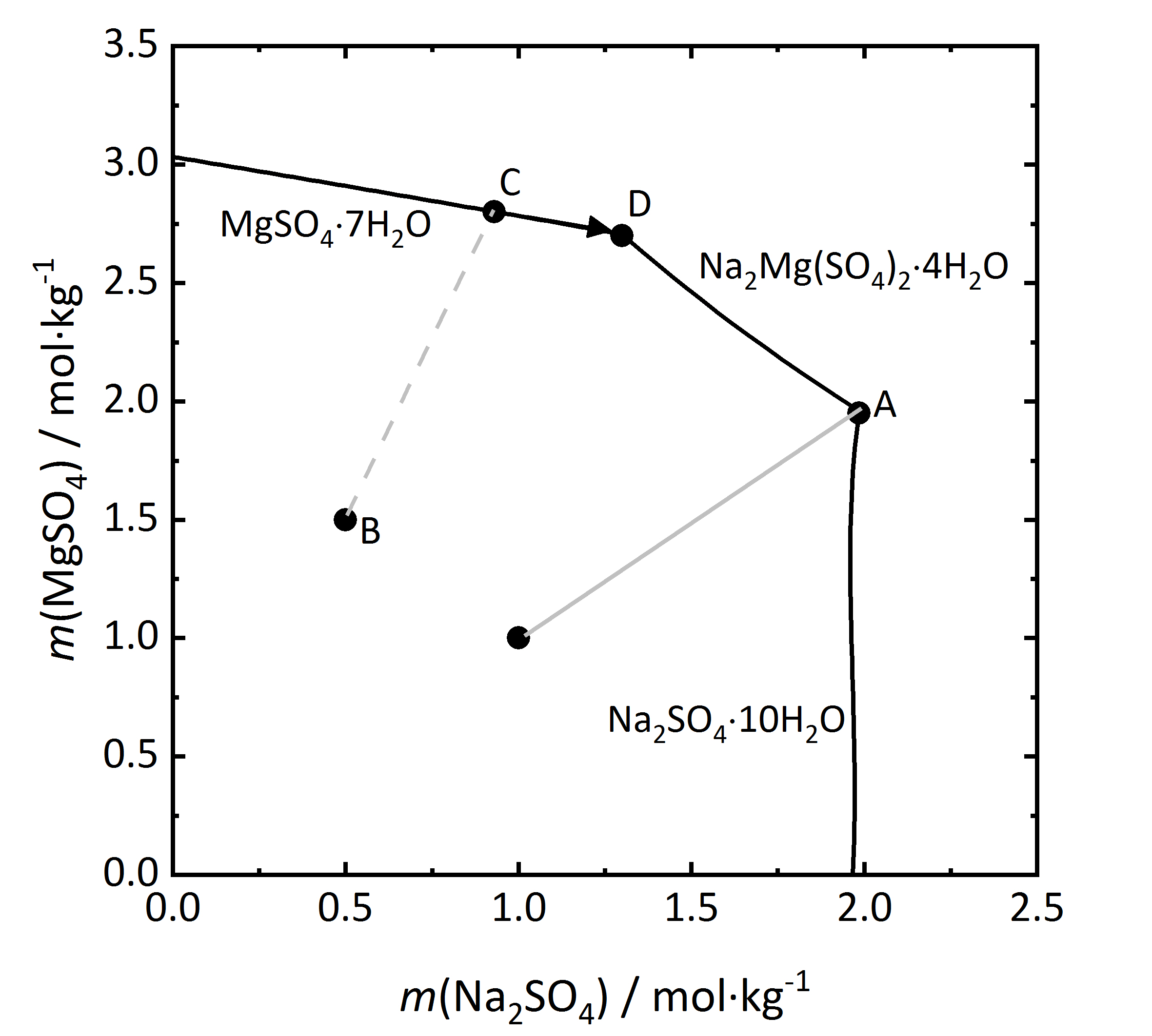
Die Betrachtung von Salzgemischen kann noch weiter ausgeführt werden. In vielen Salzmischungen können sich Doppelsalze bilden, also solche Salze, die drei oder mehr verschiedene Ionen enthalten. Wie bereits oben erwähnt, gibt es sowohl kongruent als auch inkongruent lösliche Doppelsalze. Zunächst soll ein Löslichkeitsdiagramm einer Mischung aus Na2SO4 und MgSO4 betrachtet werden (Abbildung 9), da sich in einem solchen Gemisch ein kongruent lösliches Doppelsalz (Astrakanit alias Blödit; Na2Mg(SO4)2∙4H2O) bilden kann. Auch hier sind wieder die Stoffmengenanteile der beiden beteiligten Einzelsalze gegeneinander aufgetragen, in diesem Fall bei einer Temperatur von 25 °C (die Phasen Na2SO4∙10H2O und MgSO4∙7H2O sind darauf zurückzuführen, dass sie bei dieser Temperatur in den jeweiligen Salzsystemen die stabilen Phasen darstellen). Da das Doppelsalz kongruent löslich ist, kristallisiert es aus Lösungen aus, die die gleiche Zusammensetzung haben wie das Salz selbst. Anhand der Summenformel des Salzes kann schon erkannt werden, dass es aus einer äquimolaren Mischung von Natrium- und Magnesiumsulfat auskristallisiert. Diese ist durch die hellgraue Linie im Diagramm dargestellt. Beim Erreichen der Sättigungskonzentration am Punkt A kristallisiert Blödit aus, wobei gleiche Mengen Natrium- und Magnesiumsulfat der Lösung entzogen werden. Im Verhältnis verändert sich die Lösungszusammensetzung nicht, so dass nur Blödit auskristallisiert und es sich somit wie ein Einzelsalz verhält. Ebenso ist es bei der Betrachtung des Deliqueszenzverhaltens. Liegt reines Blödit vor, so beginnt es ab seiner Sättigungsfeuchte Wasserdampf aus der Umgebung aufzunehmen und bildet zunächst eine gesättigt Lösung. Bei weiterem Anstieg der relativen Feuchte löst sich das Salz unter Bildung einer Lösung mit äquimolaren Anteilen Natrium- und Magnesiumsulfat wieder auf [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja . Wird hingegen von einer Mischung mit einem Überschuss an Magnesiumsulfat ausgegangen (Punkt B), so wird bei voranschreitender Verdunstung Magnesiumsulfat-Heptahydrat bei der entsprechenden Sättigungsfeuchte auskristallisiert (Punkt C). Die Kristallisation schreitet entlang C-D voran. Da im Verhältnis der Stoffmengenanteil von Natriumsulfat ansteigt, bildet sich Blödit an Punkt D (Endpunkt der Kristallisation).
. Wird hingegen von einer Mischung mit einem Überschuss an Magnesiumsulfat ausgegangen (Punkt B), so wird bei voranschreitender Verdunstung Magnesiumsulfat-Heptahydrat bei der entsprechenden Sättigungsfeuchte auskristallisiert (Punkt C). Die Kristallisation schreitet entlang C-D voran. Da im Verhältnis der Stoffmengenanteil von Natriumsulfat ansteigt, bildet sich Blödit an Punkt D (Endpunkt der Kristallisation).
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja
 .
.
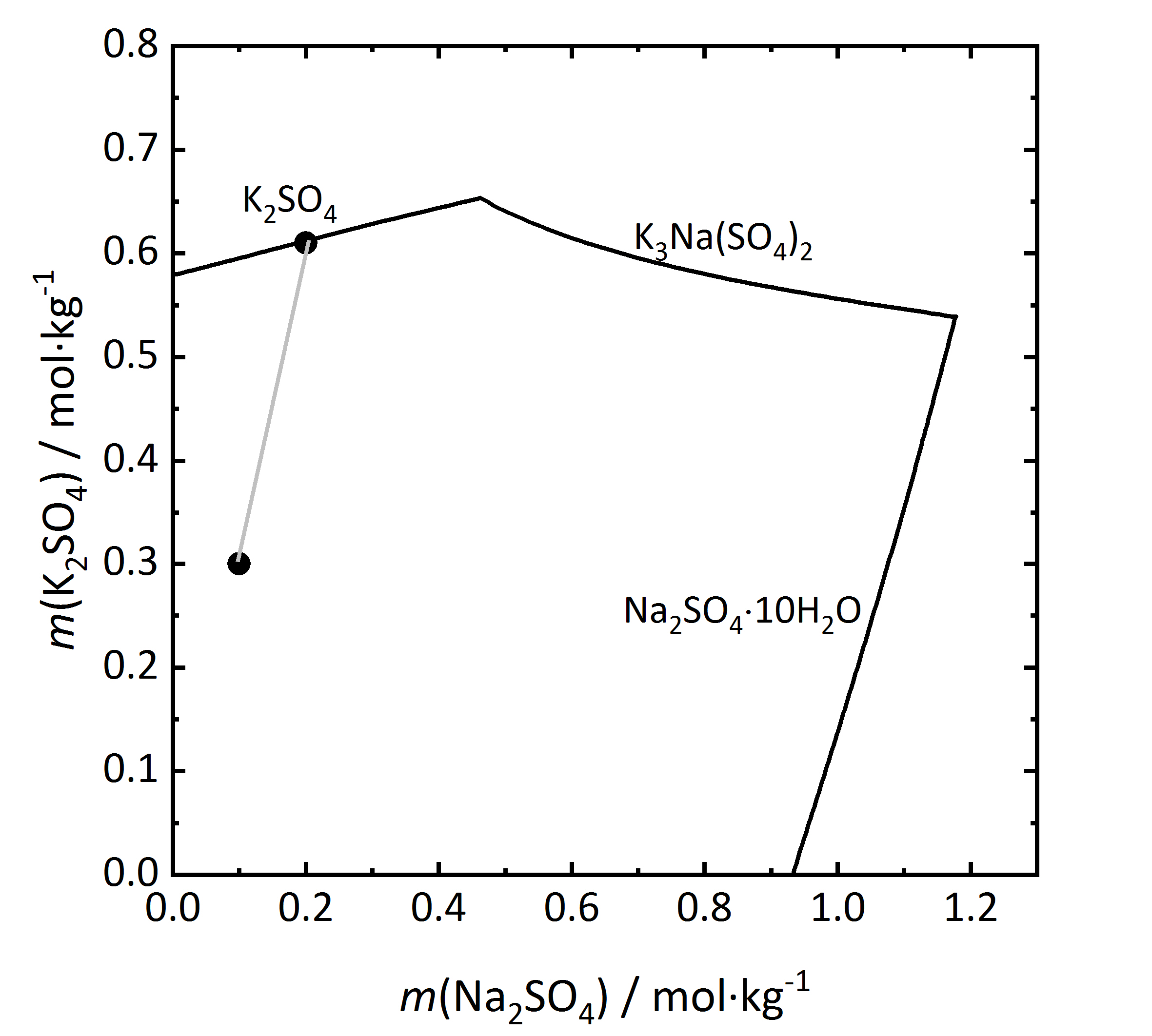
Als nächster Schritt soll in Abbildung 10 ein Löslichkeitsdiragramm eines inkongruent löslichen Doppelsalzes betrachtet werden. Aphthitalit (K3Na(SO4)2) besteht der Summenformel nach aus einer 3:1-Mischung (bezogen auf die Molalität) aus Kalium- und Natriumsulfat. Wird die Verdunstung einer Lösung mit einer solchen Zusammensetzung der Salze verfolgt (bei 15 °C), wird ersichtlich, dass Kaliumsulfat (Arcanit) auskristallisiert, jedoch nicht Aphthitalit. Es ergibt sich, dass eine in Bezug auf das Doppelsalz gesättigte Lösung in Bezug auf Arcanit übersättigt ist. Demnach würde es bei der Auflösung von Aphthitalit in Wasser nicht einfach zur Bildung einer gesättigten Lösung kommen, da Arcanit aufgrund der Übersättigung auskristallisieren würde [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja
 .
.
Bislang wurden nur Salzmischungen mit drei verschiedenen Ionen betrachtet. Das Verhalten und auch die Darstellung von Mischungen mit vier verschiedenen Ionen werden dabei deutlich komplizierter. Hinsichtlich der Darstellung wird die Wasserkomponente zum Zweck der Übersichtlichkeit nicht mit dargestellt. Eine solche Darstellung wird auch als Jänecke-Projektion [Jaenecke:1906]Title: Über eine neue Darstellungsform der wässerigen Lösungen zweier und dreier gleichioniger Salze, reziproker Salzpaare und der van't Hoffschen Untersuchungen über ozeanische Salzablagerungen.
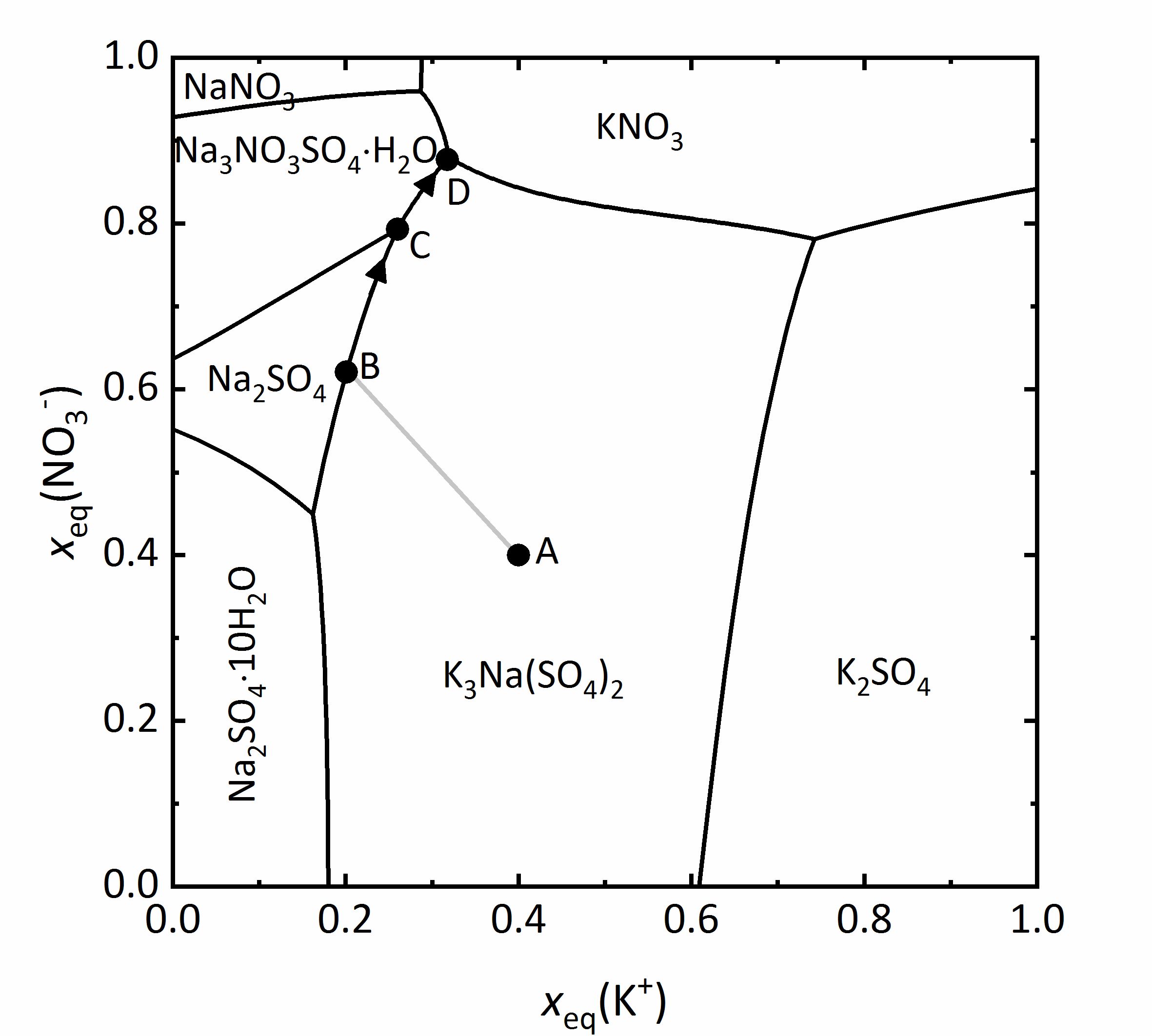
Author: Jaenecke, E. bezeichnet. Als Beispiel für ein solches Diagramm soll das eines Gemischs aus Na+-K+-NO3--SO42--H2O bei 25 °C aus Abbildung 11 besprochen werden. Auf der y-Achse sind die auf die Ladungsäquivalente bezogenen Molenbrüche der Nitrationen dargestellt, auf der x-Achse die der Kaliumionen. Alle Mischungen werden durch die auf die Ladungsäquivalente bezogenen Molenbrüche dargestellt, da auf diese Weise die Wertigkeit der Ionen berücksichtigt werden kann. Das bedeutet im Falle dieses Diagramms, dass sämtliche Mischungen als Teilbeitrag der Kalium-Kationen beziehungsweise der Nitrat-Anionen zur Gesamtmenge positiver beziehungsweise negativer Ladungen dargestellt werden. Beispielsweise leuchtet ein, dass bei sehr geringen Stoffmengenanteilen an Kalium- und Nitrat-Ionen Natrium- und Sulfat-Ionen überwiegen. Somit liegen in den Ecken die vier reinen Salze vor. Unten links Natriumsulfat, oben links Natriumnitrat, oben rechts Kaliumnitrat und unten rechts Kaliumsulfat. Die Felder innerhalb des Diagramms zeigen die Stabilitätsfelder der möglichen Phasen. Sie werden durch Linien getrennt, durch die die Sättigungskonzentrationen von Lösungen angegeben werden, bei denen die jeweils angrenzenden Phasen im Gleichgewicht vorliegen. Das heißt, dass innerhalb eines Feldes nur Sättigung in Bezug auf eine einzige Phase vorliegt, an Schnittpunkten von Sättigungskurven liegen drei Phasen gemeinsam im Gleichgewicht vor. An diesen Schnittpunkten liegen isotherme invariante Phasen vor (Phasenregel) [Steiger.etal:2014]Title: Weathering and Deterioration
bezeichnet. Als Beispiel für ein solches Diagramm soll das eines Gemischs aus Na+-K+-NO3--SO42--H2O bei 25 °C aus Abbildung 11 besprochen werden. Auf der y-Achse sind die auf die Ladungsäquivalente bezogenen Molenbrüche der Nitrationen dargestellt, auf der x-Achse die der Kaliumionen. Alle Mischungen werden durch die auf die Ladungsäquivalente bezogenen Molenbrüche dargestellt, da auf diese Weise die Wertigkeit der Ionen berücksichtigt werden kann. Das bedeutet im Falle dieses Diagramms, dass sämtliche Mischungen als Teilbeitrag der Kalium-Kationen beziehungsweise der Nitrat-Anionen zur Gesamtmenge positiver beziehungsweise negativer Ladungen dargestellt werden. Beispielsweise leuchtet ein, dass bei sehr geringen Stoffmengenanteilen an Kalium- und Nitrat-Ionen Natrium- und Sulfat-Ionen überwiegen. Somit liegen in den Ecken die vier reinen Salze vor. Unten links Natriumsulfat, oben links Natriumnitrat, oben rechts Kaliumnitrat und unten rechts Kaliumsulfat. Die Felder innerhalb des Diagramms zeigen die Stabilitätsfelder der möglichen Phasen. Sie werden durch Linien getrennt, durch die die Sättigungskonzentrationen von Lösungen angegeben werden, bei denen die jeweils angrenzenden Phasen im Gleichgewicht vorliegen. Das heißt, dass innerhalb eines Feldes nur Sättigung in Bezug auf eine einzige Phase vorliegt, an Schnittpunkten von Sättigungskurven liegen drei Phasen gemeinsam im Gleichgewicht vor. An diesen Schnittpunkten liegen isotherme invariante Phasen vor (Phasenregel) [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
Als Anwendungsbeispiel soll eine Lösungszusammensetzung von Punkt A betrachtet werden. Dieser liegt im Stabilitätsfeld von Glaserit (NaK3(SO4)2), so dass diese Phase bei Eindunstung der Lösung zuerst auskristallisieren würde. Durch die Kristallisation verändert sich bei voranschreitender Verdunstung die Lösungszusammensetzung, wobei die beteiligten Ionen proportional zu ihrem Vorkommen im auskristallisierenden Salz der Lösung entzogen werden. Dies erfolgt entlang der Linie A-B. An Punkt B liegt auch Sättigung in Bezug auf Thenardit vor, so dass die beiden Salze gemeinsam auskristallisieren. Durch weitere Kristallisation der beiden Phasen verändert sich die Lösungszusammensetzung weiter, und zwar entlang der Linie B-C. An diesem Punkt ist auch Sättigung in Bezug auf Darapskit (Na3NO3SO4∙H2O) erreicht. Da es sich bei dem Punkt jedoch um einen invarianten Punkt handelt, liegen nur dort die drei Phasen gemeinsam vor. Beim weiteren Eindunsten der Lösung muss Thenardit sich auflösen, da sein Stabilitätsfeld beim Verlauf entlang C-D verlassen wird. Endpunkt der Kristallisation ist der invariante Punkt D [Steiger:2009a]Title: Modellierung von Phasengleichgewichten
Author: Steiger, Michael [Steiger.etal:2008c]Title: An improved model incorporating Pitzer’s equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code
[Steiger.etal:2008c]Title: An improved model incorporating Pitzer’s equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code
Author: Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas .
.
Author: Steiger, Michael
 , berechnet nach [Steiger.etal:2008c]Title: An improved model incorporating Pitzer’s equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code
, berechnet nach [Steiger.etal:2008c]Title: An improved model incorporating Pitzer’s equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program codeAuthor: Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas
 .
.
Aussagekraft haben diese Phasendiagramme neben der Ableitung von Kristallisationsabfolgen aber noch in anderer Hinsicht. Die Größe der Stabilitätsfelder verschiedener Phasen geben Hinweise darüber, wie wahrscheinlich es ist, dass diese Phase aus dem Gemisch auskristallisiert. Je größer das Feld, desto mehr Zusammensetzungen können zur Phasenbildung führen. Außerdem ist es wichtig ableiten zu können, welche Phasen des Gemischs gemeinsam vorliegen können. Nur aneinander grenzende oder durch invariante Punkt verbundene Phasen können gemeinsam auftreten. Somit wäre es in dem besprochenen Beispiel nicht möglich, Mirabilit zusammen mit Kaliumnitrat oder Kaliumsulfat zu identifizieren [Steiger.etal:2014]Title: Weathering and Deterioration
Author: Steiger, Michael; Charola A. Elena; Sterflinger, Katja .
.
Literature[edit]
| [Arnold.etal:1991] | Arnold, Andreas; Zehnder, Konrad (1991): Monitoring Wall Paintings Affected by soluble Salts. In: Cather, Sharon (eds.): The Conservation of Wall Paintings: Proceedings of a symposium organized by the Coutrauld Institut of Art and the Getty Conservation Institute, London, July 13-16, The Getty Conservation Institute, 103-136. |  |
| [Espinosa.etal:2008] | Espinosa, R.; Franke, L.; Deckelmann, G. (2008): Model for the mechanical stress due to the salt crystallization in porous materials. In: Construction and Building Materials, 22 (7), 1350-1367, Url, 10.1016/j.conbuildmat.2007.04.013 |  |
| [Genkinger.etal:2007] | Genkinger, Selma; Putnis, Andrew (2007): Crystallisation of sodium sulfate: supersaturation and metastable phases. In: Environmental Geology, 52 (2), 329-337, 10.1007/s00254-006-0565-x |  |
| [Grossi.etal:2013] | Grossi, C.M.; Esbert, R.M.; Suarez del Rio, L.M.; Montoto, M.; Laurenzi-Tabasso, M. (2013): Acoustic emission monitoring to study sodium sulphate crystallization in monumental porous carbonate stones. In: Studies in Conservation, 42 (2), 115-125 |  |
| [Jaenecke:1906] | Jaenecke, E. (1906): Über eine neue Darstellungsform der wässerigen Lösungen zweier und dreier gleichioniger Salze, reziproker Salzpaare und der van't Hoffschen Untersuchungen über ozeanische Salzablagerungen.. In: Z. Anorg. Allg. Chem., 51 (), 132 |  |
| [Linnow.etal:2006] | Linnow, Kirsten; Zeunert, Anke; Steiger, Michael (2006): Investigation of Sodium Sulfate Phase Transitions in a Porous Material Using Humidity- and Temperature-Controlled X-ray Diffraction. In: Analytical Chemistry, 78 (13), 4683-4689, 10.1021/ac0603936 |  |
| [Price.etal:1994] | Price, Clifford A.; Brimblecomb, Peter (1994): Preventing salt damage in porous materials. In:: Preventive conservation: practice, theory and research. Preprints of the contributions to the Ottawa Congress, 12-16 September 1994, International Institute for Conservation of Historic and Artistic Works, 90-93. |  |
| [Steiger.etal:1995] | Steiger, Michael; Dannecker, Walter (1995): Hygroskopische Eigenschaften und Kristallisationsverhalten von Salzgemischen. In: Snethlage, Rolf (eds.): Jahresberichte Steinzerfall - Steinkonservierung für 1993, Verlag Ernst & Sohn, 115-128. |  |
| [Steiger.etal:1996] | Steiger, Michael; Zeunert, Anke (1996): Crystallization properties of salt mixtures: Comparison of experimental results and model calculations. In: Riederer, Josef (eds.): Proceedings of the 8th International Congress on Deterioration and Conservation of Stone, , 535-544. |  |
| [Steiger.etal:2008] | Steiger, Michael; Asmussen, Sönke (2008): Crystallization of sodium sulfate phases in porous materials: The phase diagram Na2SO4–H2O and the generation of stress. In: Geochimica et Cosmochimica Acta, 72 (17), 4291-4306, Url |  |
| [Steiger.etal:2008c] | Steiger, Michael; Kiekbusch, Jana; Nicolai, Andreas (2008): An improved model incorporating Pitzer’s equations for calculation of thermodynamic properties of pore solutions implemented into an efficient program code. In: Construction and Building Materials, 22 (8), 1841-1850, 10.1016/j.conbuildmat.2007.04.020 |  |
| [Steiger.etal:2014] | Steiger, Michael; Charola A. Elena; Sterflinger, Katja (2014): Weathering and Deterioration. In: Siegesmund S.; Snethlage R. (eds.): Stone in Architecture, Springer Verlag Berlin Heidelberg, 223-316, 10.1007/978-3-642-45155-3_4. |  |
| [Steiger:2009a] | Steiger, Michael (2009): Modellierung von Phasengleichgewichten. In: Schwarz, Hans-Jürgen; Steiger, Michael (eds.): Salzschäden an Kulturgütern: Stand des Wissens und Forschungsdefizite, Ergebnisse des DBU Workshops im Februar 2008 in Osnabrück, Deutsche Bundesstiftung Umwelt, Eigenverlag, 80-99. |   |
| [Xu.etal:1999] | Xu B., Schweiger G. (1999): In-situ Raman observations of phase transformation of Na2SO4 during the hydration/dehydration cycles on single levitated microparticle.. In: J. Aerosol. Sci., (), 379-380 |  |
Kategorie: Grundlagen Kategorie: Salz Kategorie:Stahlbuhk,Amelie Kategorie: R-MSteiger