Gypsum: Difference between revisions
Jump to navigation
Jump to search
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
<bibimport/> | |||
{{Infobox_Salt | {{Infobox_Salt | ||
|Footnote = <ref>http://webmineral.com/data/Gypsum.shtml seen on 30.07.2010</ref><ref>http://www.mindat.org/min-1784.html seen on 30.07.2010</ref> | |Footnote = <ref>http://webmineral.com/data/Gypsum.shtml seen on 30.07.2010</ref><ref>http://www.mindat.org/min-1784.html seen on 30.07.2010</ref> | ||
| Line 27: | Line 28: | ||
|Comments = hardly soluble in water | |Comments = hardly soluble in water | ||
}} | }} | ||
Authors: [[user:Hschwarz|Hans-Jürgen Schwarz ]], Nils Mainusch, [[user:TMueller|Tim Müller]] | |||
back to [[Sulfate]] | |||
=Calciumsulfate and Gipsum = | |||
__TOC__ | |||
<!-- | |||
== Abstract == | |||
An dieser Stelle wird das System CaSO<sub>4</sub>/H<sub>2</sub>O behandelt und im Speziellen auf Gips eingegenagen. Gips ist eines der wichtigsten Salze, die an z. B. Bauwerken und Wandmalereien für Schäden verantwortlich sind. Vor allem außen exponierte Objekte leiden unter Gipsschäden. Die Eigenschaften, die Schadenswirkung, das Vorkommen und auch der Nachweis von Gips werden behandelt. Abbildungen, Mikroaufnahmen und Beispiele aus der Praxis ergänzen und veranschaulichen das Dargelegte.<br> | |||
<br> | |||
== Einleitung == | |||
Gips ist eines der heute am häufigsten vorkommenden bauschädlichen Salze. Er kommt in unterschiedlichen Formen und Ausprägungen an fast allen Objekten am Außenbau vor. Auch in Innenräumen ist er häufig zu finden.<br> | |||
<br> | |||
<br> | |||
== Vorkommen von Gips == | |||
Als eines der am meisten verbreiteten Minerale entsteht Gips beim Ausfall aus wässrigen Lösungen bei Temperaturen unter ca. 40°C. Liegen erhöhte Temperaturen (> 60°C) einer Lösung vor, so wird direkt Anhydrit gebildet. In Form von Gesteinen sind beide Calciumsulfatformen häufig anzutreffen. Natürliche Vorkommen des Halbhydrates existieren nicht. <br> | |||
Gips findet sich als Vorkommen in Salzlagerstätten und in Salzwüsten, wo durch den Einschluss von Quarzpartikeln bei der Formierung des Kristalls häufig sogenannte Wüstenrosen entstehen. In Salzlagerstätten bilden Gips und Anhydrit zuweilen einen "Salzhut" aus, d.h. eine mächtige Materialschicht, die sich über anderen Salzvorkommen eines natürlichen Lagers befindet. Künstlich hergestellter Gips entsteht u.a. im Zuge der Entschwefelung von Rauchgasen in Kraftwerken, in denen fossile Brennstoffe verwertet werden. | |||
== Herkunft und Bildung von Gips an Baudenkmalen == | |||
Die hohe Schadensrelevanz von Gips für Denkmale aus mineralischer Bausubstanz steht wesentlich in Zusammenhang mit der Umwandlungsreaktion von Kalk zu Gips. Unter der Einwirkung von SO<sub>x</sub>-haltiger Luft in Verbindung mit Feuchte können auf diese Weise wichtige Materialkomponeneten von Bauwerken (Kalkmörtel, Verputz, calcitische Gesteine etc.) zu Gips entsprechend dem Chemismus: | |||
CaCO<sub>3</sub> + H<sub>2</sub>SO<sub>4</sub> → CaSO<sub>4</sub> + H<sub>2</sub>O + CO<sub>2</sub> | |||
umgewandelt werden. Gips stellt darüberhinaus einen wichtigen Baustoff für die Erstellung von Mörtel und Verputzen dar und kann bereits als Gestein und somit originäres Baumaterial Eingang in das Gefüge eines Denkmals gefunden haben. Ähnliches gilt für Anhydrit. | |||
<br> | |||
<br> | |||
<br> | |||
== Schadenspotential und Verwitterungsaktivität == | |||
--> | |||
=== Solubility properties === | |||
[[file:CaSO4 sol.JPG|thumb|350px|right|'''Figure1:''' Solubility of CaSO4 in water (diagram: Michael Steiger)]] | |||
<!-- | |||
<br>Gips zählt zur Gruppe der "gering" wasserlöslichen Salze und kann somit als wenig mobil bezeichnet werden. Allerdings ist der Fremdioneneinfluss auf die Gipslöslichkeit vergleichsweise groß. So wird die Löslichkeit von Gips durch Halit je nach Konzentrationsverhältnis bis um den Faktor vier erhöht.<br> | |||
--> | |||
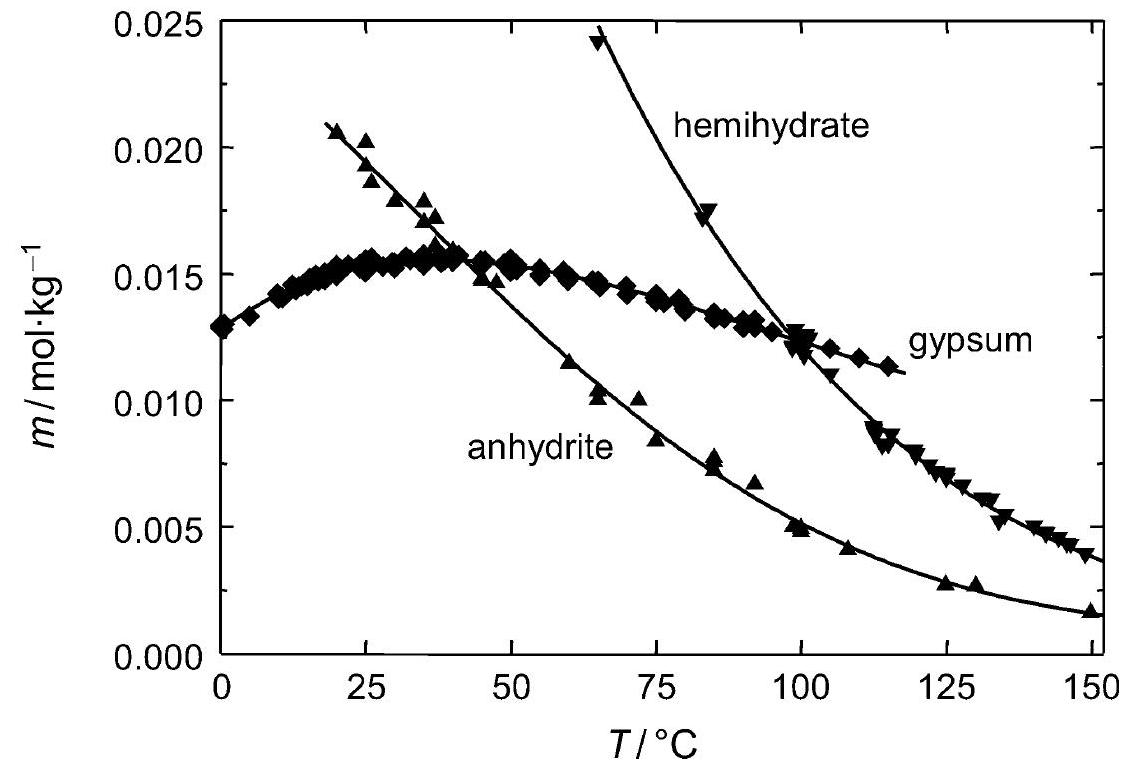
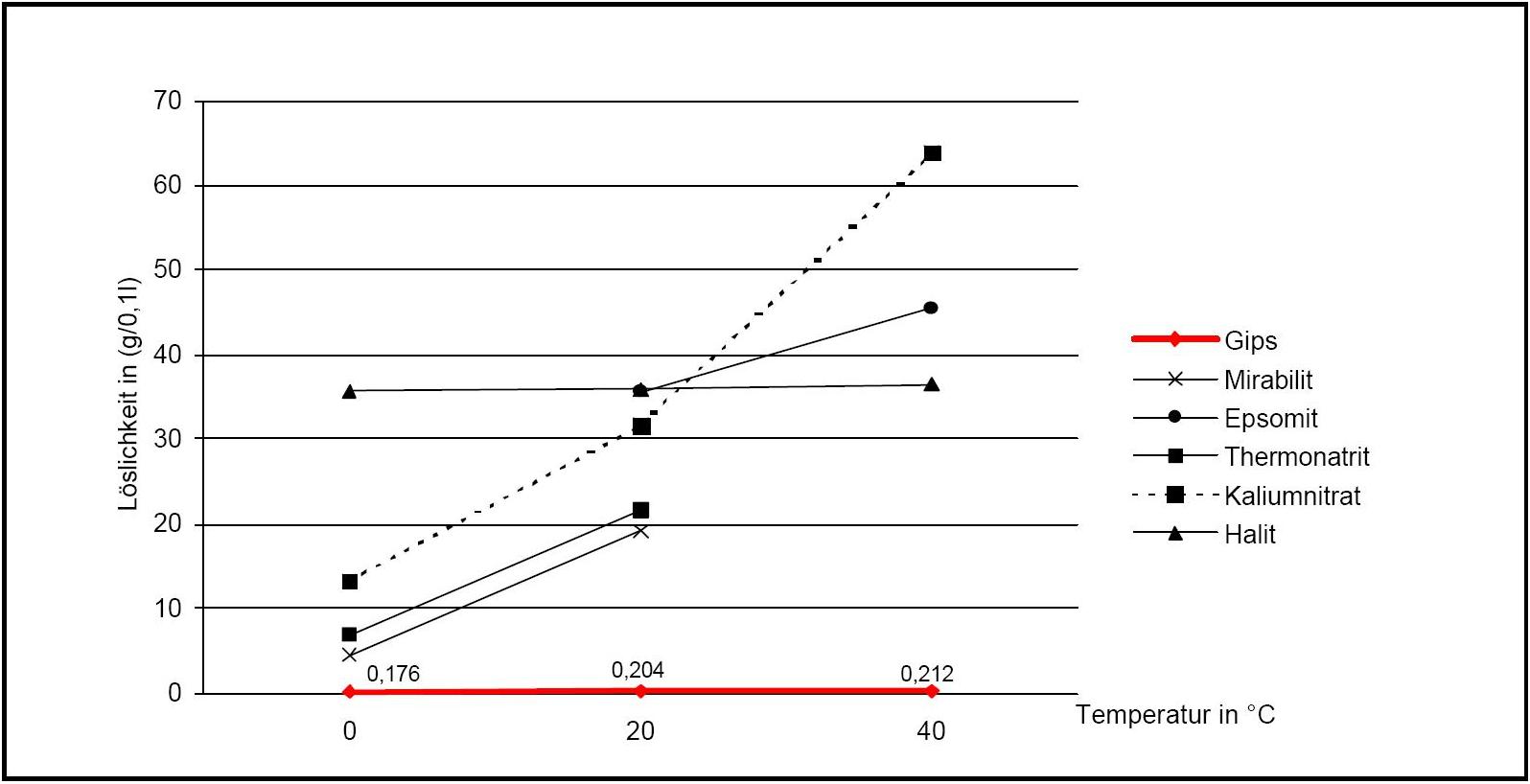
[[file:Loeslichkeit Gips 02.JPG|thumb|right|350px|'''Figure 2:'''Solubility of gipsum compared with other salte (after <bib id=Stark.etal:1996/>)]] | |||
<!-- | |||
=== Hydratationsverhalten === | |||
Das System CaSO<sub>4 </sub>– H<sub>2</sub>O: <br> Calciumsulfat kann in drei unterschiedlichen Hydratstufen auftreten, dem oben bezeichneten kristallwasserlosen Anhydrit, einem Halbhydrat, welches unter Normalbedingungen die instabilste Form darstellt, und Gips. Anhydrit existiert in verschiedenen Modifikationen, wodurch je nach Abhängigkeit der Modifikation des vorliegenden Anhydrit unterschiedliche chemische Eigenschaften (z.B. variierende Löslichkeit in Wasser) feststellbar sind. Das gleiche gilt auch für die Modifikationen des Halbhydrates. <br> | |||
Als Wert für die Übergangstemperatur (in wässriger Lösung) kann der Bereich 40°C-66°C angegeben werden. Unter normalen Klimabedingungen an Denkmalen entsteht somit beim Ausfall von Calciumsulfat aus einer wässrigen Lösung in erster Linie Gips. Liegen die Temperatur einer Lösung höher als 40°C-60°C, bildet sich v.a. Anhydrit. Parallel hierzu kommt es zur Bildung des Halbhydrates, welches zwar metastabil ist, beim Ausfall aber zunächst in großer Menge auftritt und dann in eine der stabileren Hydratstufen umgebildet wird. <br> | |||
Bei der Erhitzung des Dihydrates (als Feststoff in Abwesenheit von wässrigem Lösungsmittel) kommt es bei einer Temperatur ab etwa 50°C zum Austreiben von Kristallwasser und es entsteht das Halbhydrat. Die vollständige Überführung zum Halbhydrat findet erst bei Temperaturen von ca. 100°C statt. Wird das Dihydrat längere Zeit auf 500-600°C erhitzt, liegt völlig entwässertes Calciumsulfat vor. Bei Temperaturen über 1000°C erfolgt die Zersetzung in Calciumoxid und SO<sub>3</sub>. | |||
<br clear=all> | |||
=== Hygroskopizität === | |||
[[Datei:Veraenderung Loeslichkeit durch Fremdionen Gips .JPG|thumb|right|350px|'''Abbildung 3''': Dargestellt ist die Veränderung der Löslichkeit von Gips in Wasser unter Anwesenheit von [[Halit]] Liegt Halit in einer Konzentration von ca. 140 g/l in wässriger Lösung vor, so lösen sich hierin etwa 8 g Gips (Angaben nach <bib id=DAns:1933/>)]] | |||
Gips besitzt als Reinsalz keinen definierten und durch die relative Feuchte beeinflussten Deliqueszenzpunkt. Bei Überschreiten von 90 % r.F. kann es in Gegenwart von [[Halit]] allerdings (durch die Feuchtesorption von [[Halit]]) zum Auflösen von Gipskristallen kommen; ein Absinken der Feuchtewerte auf ca.75 % r.F. bewirkt die Rekristallisation des Gipses. | |||
=== Kristallisationsdruck === | |||
Bei der Kristallisation aus wässriger Lösung, die eine Übersättigung im Verhältnis 2:1 aufweist, läßt sich für Gips ein linearer Wachstumsdruck von 28,2-33,4 N/mm<sup>2</sup> im Temperaturbereich 0-50°C angeben. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte im mittleren Bereich einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm<sup>2</sup> reicht [nach <bib id=Winkler:1975/>]. | |||
=== Hydratationsdruck === | |||
An einem Objekt vorliegender Gips kann das im Kristallgitter enthaltene Kristallwasser nur bei Temperaturen ab ca. 50°C abgeben, wird also in der Regel nicht dehydrieren. Umgekehrt ist die Einlagerung von Kristallwasser bei Vorliegen von Anhydrit oder Halbhydrat an einem Denkmal aber durchaus möglich. Beide Vorgänge sind mit Volumenveränderungen (von 31,9% beim Übergang Halbhydrat-Gips) und dem Entstehen von [[Schadensmechanismen|Hydratationsdrücken]] verbunden [Zahlenwerte nach <bib id="Sperling.etal:1980"/>]. Für den Fall des Überganges Halbhydrat-Gips (Stichwort Gipstreiben) kann bei einer Temperatur im Bereich 0-20°C und einer r.F. von ca. 80% ein [[Schadensmechanismen|Hydratationsdruck]] von 114 –160 N/mm<sup>2</sup> angegeben werden, was extrem hohe Werte darstellt [nach <bib id=Stark.etal:1996/>]. | |||
== Umwandlungsreaktionen == | |||
Wie erläutert hängt der substanzgefährdende Charakter von Gips v.a. mit der Umwandlungsreaktion Calcit-Gips zusammen. Aus Calcit gebildete Gipsmoleküle besitzen ein Volumen, welches das der ursprünglichen Calcitmoleküle um etwa 100% übersteigt. In diesem Zusammenhang ist als relevanter Schadensfaktor die Veränderung der Wasserlöslichkeit zu nennen. Calcit ist mit einer Wasserlöslichkeit von ca. 0,014g/l (20°C) schwerer löslich als Gips, so dass nach Umwandlung zu Gips ein deutlich wasserempfindlicheres System vorliegt. Hingewiesen sei auf die Untersuchungen von Snethlage und Wendler [<bib id=Snethlage.etal:1998/>], die den Einfluss von Gips auf die hygrischen Längenänderungen eines bestimmten Sandsteinmaterials analysiert haben und die beobachtete Schadensbildung in erster Linie auf das veränderte Quellverhalten durch den Gipseinfluss erklären. | |||
<br> | |||
== Analytischer Nachweis == | |||
--> | |||
<!-- | |||
=== Mikrochemie === | |||
--> | |||
<!-- | |||
=== Mikroskopie === | |||
'''Laboruntersuchung:''' Gips ist gering wasserlöslich, so dass gipshaltiges Probematerial beim Versetzen mit Aquadest nur geringfügig in Lösung geht. Wird gipshaltiges Probematerial in Lösung gebracht, entstehen bei vorsichtigem Einengen des Lösungmitteltropfens im Zuge der Rekristallisation zunächst Einzelnadeln und zunehmend nadelige Gipsaggregate im Bereich des Saumes der Lösung (alternativ kann Probematerial mit Salzsäure versetzt werden, was ebenfalls zur Bildung von Kristallnadeln führt). Im Vergleich zu anderen Salzen, die ebenfalls nadelig rekristallisieren können wie z.B. [[Natrit|Natriumcarbonat]], weisen Gipsnadeln eine deutlich geringere Länge auf.<br> | |||
'''Brechungsindizes:''' n<sub>x</sub> = 1.521; n<sub>y</sub> =1.523; n<sub>z</sub> =1.530<br>'''Doppelbrechung''': Δ = 0.009<br>'''Kristallklass'''e: monoklin<br> | |||
'''[[Polarisationsmikroskopie|Polarisationsmikroskopische Untersuchung:]]'''<br>Außer dem typischen nadeligen Habitus von Gipskristallen (v.a. von rekristallisiertem Material) treten unterschiedliche morphologische Charakteristika auf, die bei der Identifikation von Gips hilfreich sind. Gipspartikel (in Rohprobematerial) zeigen sich häufig in Form von gerundeten Splittern und tafeligen Rhomboedern an denen deutliche, innere Spaltflächen ablesbar sind. Darüber hinaus ist das Auftreten von Zwillingsformen sowohl bei lattigen Partikeln wie auch Tafeln und Plättchen typisch für Gips. Die Zuweisung der Brechungsindizes erfolgt entsprechend der Immersionsmethode unter Verwendung von Medien mit den Indizes nD=1,518 und nD=1,53, wobei aufgrund der zumeist sehr kleinteiligen Partikel die Überprüfung des Schroeder van der Kolk- Schatten aussagekräftiger und sicherer ist, als der Becke-Linien Test. | |||
Gipskristalle gehören zur Klasse der monoklinen Kristalle, zeigen also je nach Ausrichtung des Einzelpartikels unter dem Mikroskop zum einen sowohl parallele bzw. symmetrische Auslöschung, weisen v.a. jedoch eine charakteristische schiefe Achsenstellung in der Auslöschungsposition auf. An gut ausgebildeten Kristallrhomben ist diese schiefe Auslöschung zumeist klar messbar. Von allen Calciumsulfaten ist Gips am geringsten doppelbrechend und erscheint bei gekreuzten Polarisatoren mit sehr niedrigen Interferenzfarben, die (natürlich in Abhängigkeit der vorliegenden Partikeldicke) im Bereich grau bis gelblich weiß der ersten Ordnung liegen. | |||
<br>'''Verwechslungsmöglichkeiten:'''<br>Gips ist im dargestellten Analyseverfahren eindeutig zuweisbar, sofern die folgenden Untersuchungskriterien eindeutig geklärt sind:<br> | |||
*geringe Wasserlöslichkeit | |||
*charakteristisch nadelige Morphologie bei rekristallisierten Partikeln | |||
*alle beobachtbaren Indizes besitzen einen n<sub>D</sub> –Wert zwischen 1,518 und 1,530 | |||
*Gipskristalle besitzen eine geringe Doppelbrechung und niedrige Interferenzfarben | |||
*Gipskristalle weisen eine schiefe Auslöschung auf | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | |||
|+''Tabelle 1: Salzphasen mit gipsähnlichen chemischen und optischen Eigenschaften'' | |||
|- | |||
|bgcolor = "#F0F0F0"|'''Salzphase''' | |||
|bgcolor = "#F0F0F0"|'''Unterscheidungsmerkmale''' | |||
|- | |||
|bgcolor = "#F7F7F7"|'''[[Syngenit]]''' K<sub>2</sub>Ca(SO<sub>4)</sub> • 2H<sub>2</sub>O | |||
|bgcolor = "#FFFFEO"|alle beobachtbaren Indizes < 1,518 | |||
|- | |||
|bgcolor = "#F7F7F7"|'''[[Tachyhydrit]]''' CaMg<sub>2</sub>Cl<sub>6</sub> • 12H<sub>2</sub>O | |||
|bgcolor = "#FFFFEO"|zumeist ein beobachtbarer Index < 1,518 / nur parallele und symmetrische Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"|'''[[Hydromagnesit]]''' Mg<sub>5</sub>[OH(CO<sub>3</sub>)<sub>2</sub>]<sub>2</sub> • 4H<sub>2</sub>O | |||
|bgcolor = "#FFFFEO"|ein Index zumeist > 1,53 | |||
|} | |||
<br> | |||
--> | |||
<!-- | |||
== Röntgendiffraktometrie == | |||
== Raman-Stektroskopie == | |||
== DTA / TG == | |||
== IR-Spektroskopie == | |||
= Umgang mit Gipsschäden = | |||
--> | |||
== Photos of gypsum crystals and deterioration pattern caused by gypsum== | |||
=== On a object === | |||
<gallery caption="" widths="200px" heights="150px" perrow="3"> | |||
Image:Perleberg 14.04.2003 (50)-Ausschnitt.jpg|salt damage on a brick, St. Jakobi Perleberg | |||
Image:| | |||
Image:| | |||
</gallery> | |||
<br clear=all> | |||
=== Under the polarising microscope === | |||
<gallery caption="In thin section of bricks" widths="200px" heights="150px" perrow="3"> | |||
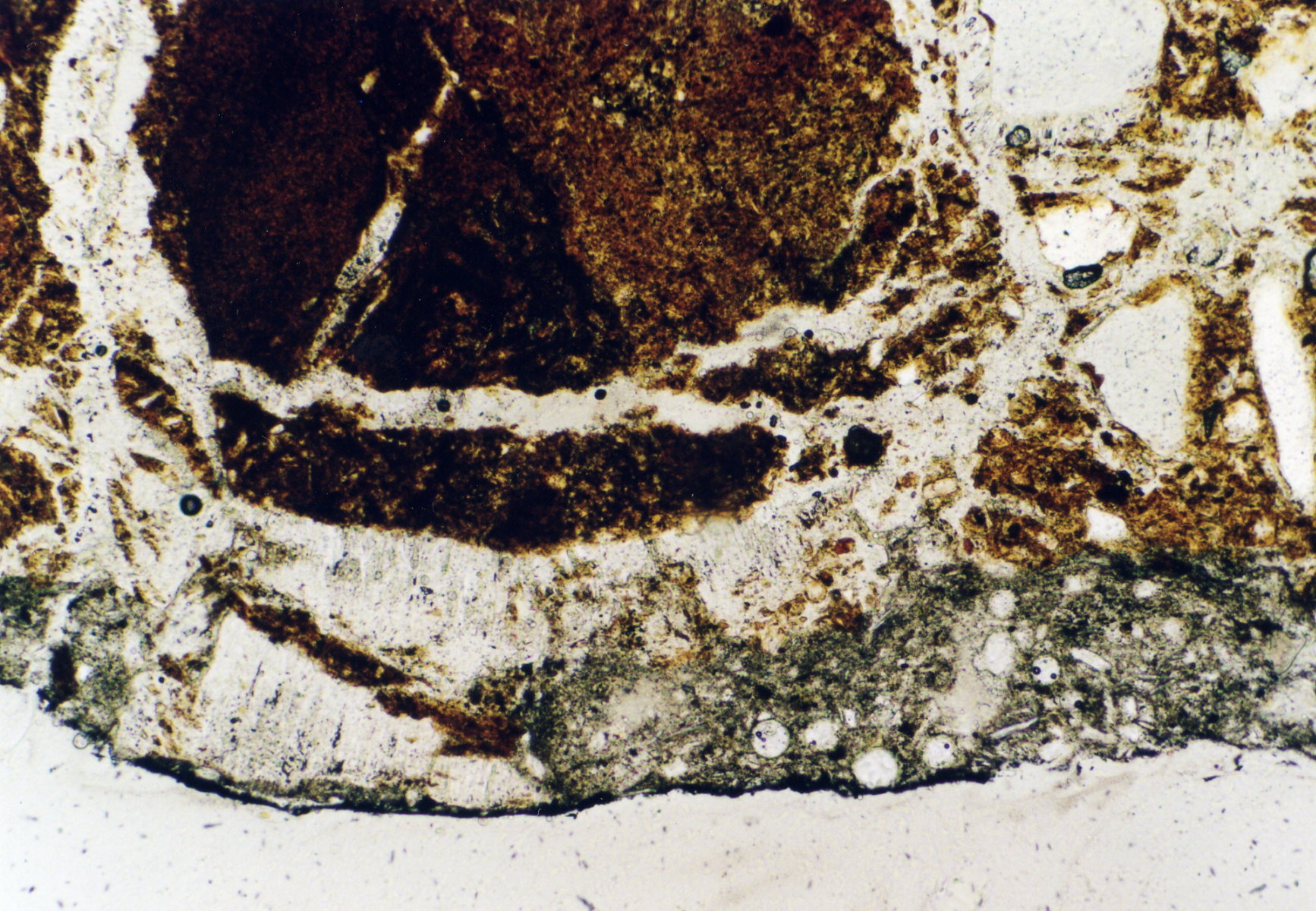
Image:Per_270603_5-13_14.jpg|Brick with gypsum caused damage, St. Jakobi Perleberg | |||
Image:Per_270603_5-13_15.jpg|Brick with gypsum caused damage, St. Jakobi Perleberg | |||
Image:Eilsum_Gips_duennschliff.jpg | |||
</gallery> | |||
<gallery caption="Gypsum crystallized out of a solution in water on a glass slide" widths="200px" heights="150px" perrow="3"> | |||
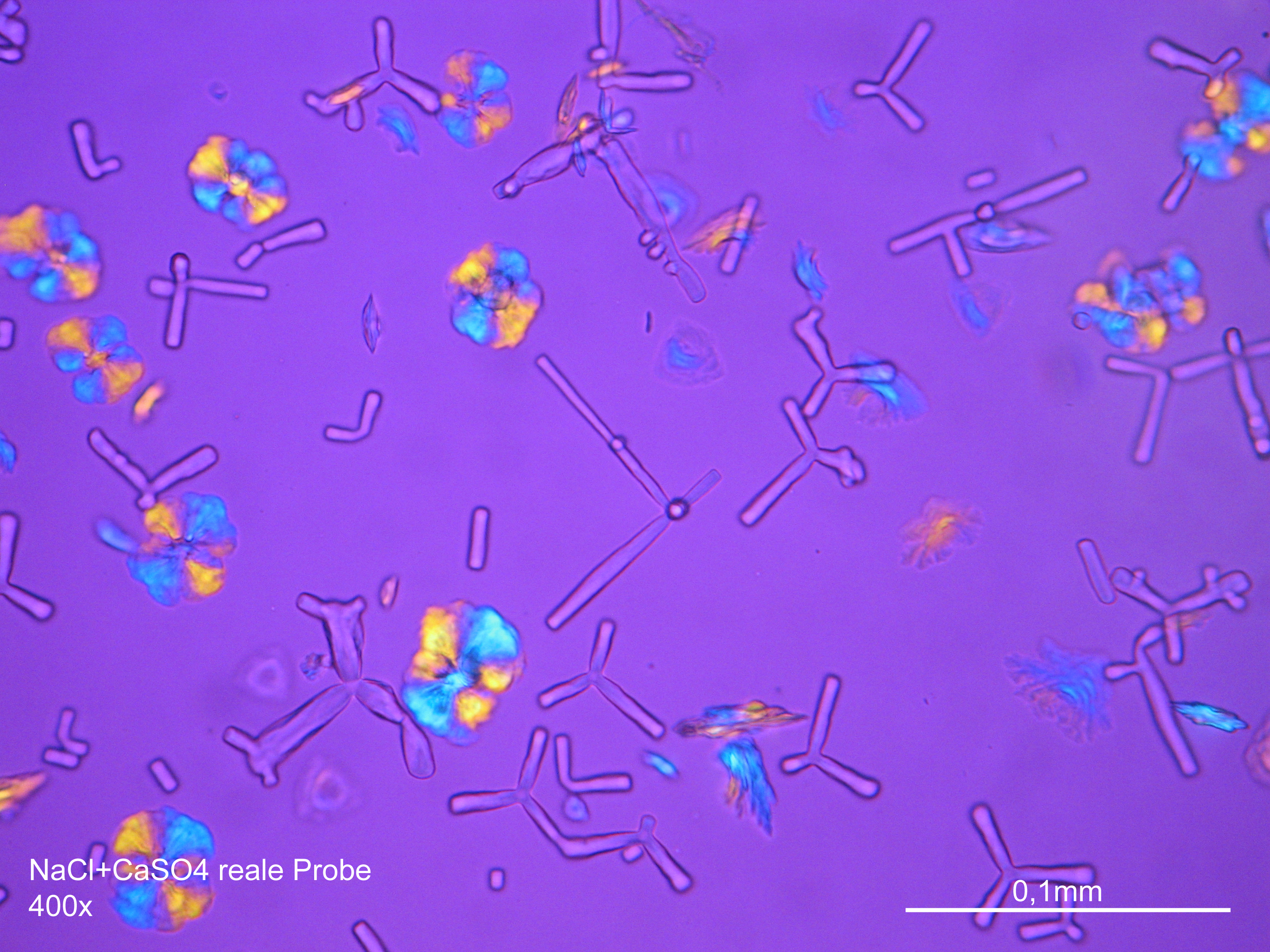
Image:CaSO4 pol 400x 01.JPG|Calcium sulfate crystallized out of a solution in water on a glass slide | |||
Image:CaSO4+NaCl reale Probe 01.JPG|Calcium sulfate with sodium chloride of a real sample, Gypsum crystallized out of a solution in water on a glass slide | |||
Image:CaSO4+NaCl reale Probe 02.JPG|Calcium sulfate with sodium chloride of a real sample, Gypsum crystallized out of a solution in water on a glass slide | |||
Image:HJS CaSO4 092503-1.jpg|Calcium sulfate, Gypsum crystallized out of a solution in water on a glass slide | |||
</gallery> | |||
<br clear=all> | |||
== Under the Scanning Electron Microscope (SEM) == | |||
<gallery caption="In a SEM" widths="200px" heights="150px" perrow="3"> | |||
Image:SA100_1.jpg | Gypsum crystals in a SEM | |||
Image:SG2-2.jpeg | Gypsum crystals in a SEM | |||
Image:SG2-3.jpg | Gypsum crystals in a SEM | |||
Image:SG3-SPC2.jpeg | Gypsum crystals in a SEM | |||
Image:SG3-3.jpeg | Gypsum crystals in a SEM | |||
Image:SG3-4.jpeg | Gypsum crystals in a SEM | |||
Image:SG1-5.jpeg | Gypsum crystals in a SEM | |||
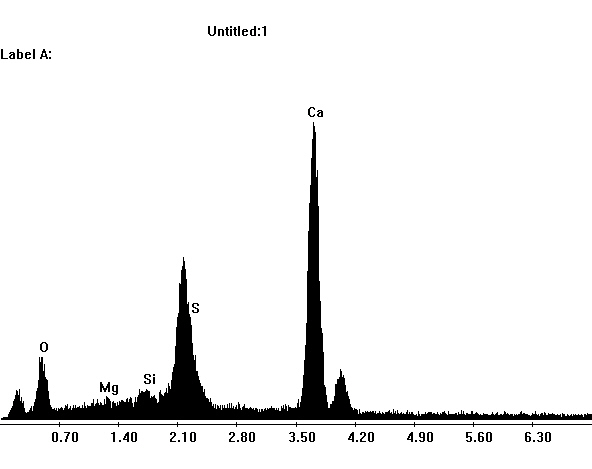
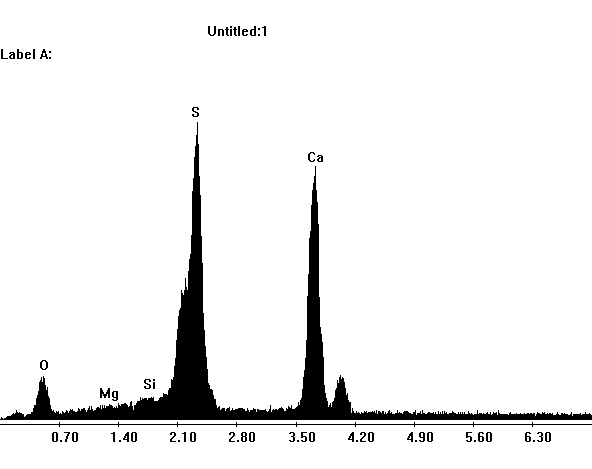
Image:SG1-SPC.jpeg | EDX spektra of gypsum crystals in a SEM | |||
</gallery> | |||
<br clear=all> | |||
== Weblinks == | |||
<references /> | |||
== Literatur == | |||
<bibprint/> | |||
== Weblinks == | == Weblinks == | ||
Revision as of 16:24, 26 December 2011
<bibimport/>
| Gypsum[1][2] | |

| |
| Mineralogical name | Gypsum, Selenite |
| Chemical name | Calcium sulfate dihydrate |
| Trivial name | Gypsite, Sulfate of Lime |
| Chemical formula | Ca[SO4]•2H2O |
| Other forms | Anhydrite (CaSO4) Hemihydrate (CaSO4•0.5H2O) |
| Crystal system | monoclinic |
| Crystal structure | |
| Deliquescence humidity 20°C | |
| Solubility (g/l) at 20°C | 2.14 g/l |
| Density (g/cm³) | 2.2-2.4 g/cm³ |
| Molar volume | 74.69 cm3/mol |
| Molar weight | 172.17g /mol |
| Transparency | transparent to opaque |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | hardly soluble in water |
| Crystal Optics | |
| Refractive Indices | α = 1.519-1.521 β = 1.522-1.523 γ = 1.529-1.530 |
| Birefringence | Δ = 0.010 |
| Optical Orientation | biaxial positive |
| Pleochroism | |
| Dispersion | 58° |
| Used Literature | |
| {{{Literature}}} | |
Authors: Hans-Jürgen Schwarz , Nils Mainusch, Tim Müller
back to Sulfate
Calciumsulfate and Gipsum[edit]
Solubility properties[edit]

Figure 2:Solubility of gipsum compared with other salte (after [Stark.etal:1996]Title: Bauschädliche Salze
Author: Stark, Jochen; Stürmer, Sylvia
 )
)
Author: Stark, Jochen; Stürmer, Sylvia
 )
)Photos of gypsum crystals and deterioration pattern caused by gypsum[edit]
On a object[edit]
Under the polarising microscope[edit]
- In thin section of bricks
- Gypsum crystallized out of a solution in water on a glass slide
Under the Scanning Electron Microscope (SEM)[edit]
- In a SEM
Weblinks[edit]
- ↑ http://webmineral.com/data/Gypsum.shtml seen on 30.07.2010
- ↑ http://www.mindat.org/min-1784.html seen on 30.07.2010
Literatur[edit]
[Filter missing]