Epsomite: Difference between revisions
Jump to navigation
Jump to search
m (Protected "Epsomite" ([edit=sysop] (indefinite) [move=sysop] (indefinite))) |
No edit summary |
||
| Line 28: | Line 28: | ||
}} | }} | ||
<bibimport/> | |||
Authors: [[user:Hschwarz|Hans-Jürgen Schwarz]], [[user:TMueller|Tim Müller]], Nils Mainusch | |||
<br> | |||
back to [[Sulfate]] | back to [[Sulfate]] | ||
<!-- | |||
== Einleitung == | |||
== Vorkommen von Epsomit == | |||
Als natürliches Mineral wurde Epsomit im Jahr 1695 erstmalig aus den Mineralwässern des Ortes Epsom (bei London) gewonnen, woher die mineralogische Namensgebung rührt. Ebenso wie [[Kieserit]] (Magnesiumsulfatmonohydrat) treten Einzelkristalle in der Natur selten auf. Beide Magnesiumsalze wie auch weitere Hydratstufen werden in alpinen Lagerstätten abgebaut und erscheinen zusammen mit [[Sylvin]] und [[Halit|Steinsalz]] in Norddeutschland und in den Abraumsalzen des Staßfurter Gebietes (bei Magdeburg). | |||
== Angaben zu Herkunft und Bildung von Epsomit an Baudenkmalen == | |||
Die Bildung von Magnesiumsulfaten an Denkmalen setzt das Vorhandensein löslicher Magnesiumverbindungen, bzw. von Magnesiumionen voraus. An historischen Bauten können unterschiedliche Materialien Verwendung finden, in denen Magnesiumverbindungen enthalten sind. Einige Beispiele seien nachfolgend aufgeführt:<br> | |||
*'''Verwendung von Kalk mit dolomitischem Anteil''': [[Dolomit]] ist ein Doppelsalz der Zusammensetzung CaMg(CO<sub>3</sub>)<sub>2</sub>. Wird dolomithaltiger Kalk gebrannt, gelöscht und als Mörtelmischung verwendet, liegt nach dem Prozess der Carbonatisierung sowohl CaCO<sub>3</sub> wie auch MgCO<sub>3</sub>·xH<sub>2</sub>0 vor (beispielsweise in Form von [[Nesquehonit]], also mit drei Kristallwassermolekülen in der Form MgCO<sub>3</sub>·3H<sub>2</sub>0). Die Wasserlöslichkeit von MgCO<sub>3</sub>·3H<sub>2</sub>0 liegt mit ca. 1,76 g/l deutlich über den Löslichkeiten von [[Calcit]] (0,014 g/l) und [[Dolomit]] (0,078 g/l). Durch Feuchteeinwirkung gelöste Magnesiumionen können mit entsprechenden Anionen verschiedene Magnesiumsalze bilden. Die Bildung von Magnesiumsulfat kann forciert erfolgen, wenn in Verbindung mit dolomithaltigem Verputz Stuckgips oder Gipsputz am Objekt verwendet wurde und somit Sulfat im Überschuss vorliegt. | |||
*'''Verwendung von Magnesiabinder''': Magnesiabinder besteht im wesentlichen aus MgO und MgCl<sub>2</sub> oder Magnesiumsulfat. Das ausreagierte und verfestigte Bindemittel kann stark hygroskopische Magnesiumsalze enthalten, welche zu Magnesiumsulfat umgebildet werden können. | |||
*'''Verwendung von Zement''': Nach DIN 1164 <bib id="DIN1164:1994"/> ist in Zementen eine Höchstgehalt an MgO von 5 M.% zugelassen. Außer der Möglichkeit bei zeitverzögert verlaufendem Ablöschen durch sogenanntes „Magnesiatreiben“ Schäden zu verursachen, können theoretisch Magnesiumionen freigesetzt werden und zur Bildung von Magnesiumsulfat führen. | |||
Als weitere Quelle einer möglichen Magnesiumsulfatbildung ist Streusalz anzuführen, welches oft einen geringen Anteil des leichtlöslichen MgCl<sub>2</sub> enthält. Weiterhin kann eine Magnesiumzufuhr durch stete Bodenauslaugung bei aufsteigender Feuchte erfolgen. | |||
<br> | |||
== Solibiliy properties == | |||
[[file:MgSO4_s.jpg|thumb|350px|right|'''>Figure 1''': Solubility of MgSO<sub>4</sub> in water (Diagram: Michael Steiger)]] | |||
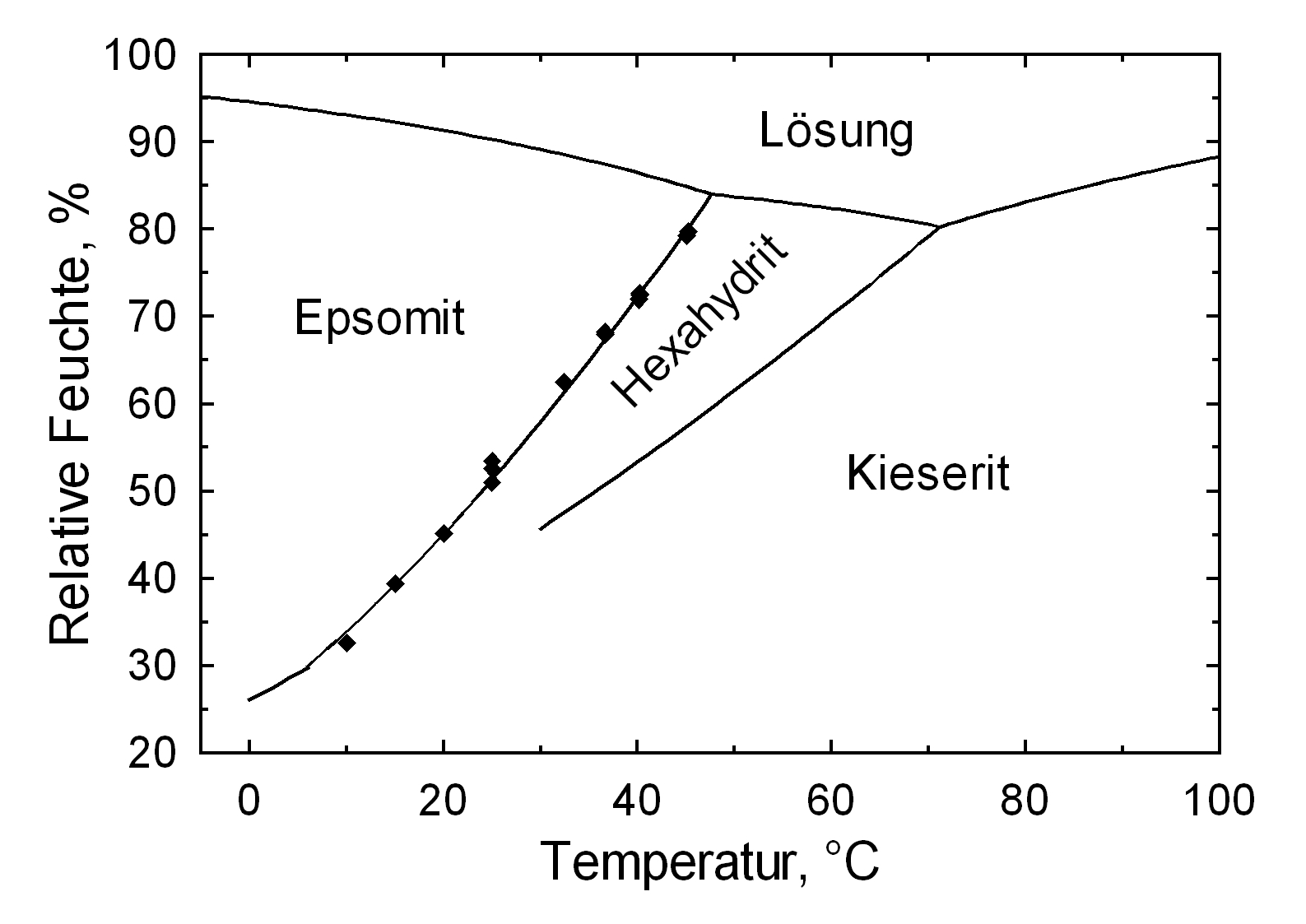
[[fil:Loeslichkeit Epsomit 01.JPG|thumb|350px|right|'''Figure 2''': Darstellung der temperaturabhängigen Veränderung der Löslichkeit von Epsomit im Vergleich mit anderen Salzphasen (nach <bib id=Stark.etal:1996/>)]] | |||
<!-- | |||
Alle oben beschriebenen Magnesiumsulfathydratformen zählen mit einer Löslichkeit von deutlich über 100 g/l (bei 20°C) zur Gruppe der leichtlöslichen Salze. Damit ist im Prinzip eine große Mobilität des Salzes und eine häufige Verschiebung der Anreicherungszonen im Materialgefüge verbunden. Mit dem Temperatureinfluss auf die Löslichkeit kann die Gefahr eines Ausfallens gelöster Salze bei raschem Temperaturabfall verbunden sein. | |||
--> | |||
<br> | |||
== Hygroskopicity == | |||
<!-- | |||
Die geringe Hygroskopizität des Reinsalzes Epsomit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich 88-90 % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunkt tiefer (siehe Tab.). Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. <br> | |||
--> | |||
[[file:MgSO4_a.jpg|thumb|350px|right|'''Fifure 2:''' The system MgSO<sub>4</sub>/H<sub>2</sub> form -30°C to 80°C , (Diagram: Michael Steiger)]] | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 1:Deliqueszenzpunkte in Abhängigkeit zur Temperatur [nach <bib id=Arnold.etal:1991/>]'' <!-- Tabellenüberschrift einfügen --> | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| 10°C | |||
|bgcolor = "#F0F0F0" align=center| 20°C | |||
|bgcolor = "#F0F0F0" align=center| 25°C | |||
|bgcolor = "#F0F0F0" align=center| 30°C | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| 86,9% r.F. | |||
|bgcolor = "#FFFFEO" align=center| 90,1% r.F. | |||
|bgcolor = "#FFFFEO" align=center| 88,3% r.F. | |||
|bgcolor = "#FFFFEO" align=center| 88,0% r.F. | |||
|} | |||
<br> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | |||
|+''Tabelle 2: Gleichgewichtsfeuchte im Salzgemisch (Mischungsverhältnis: Gesättigte Lsg. A/ gesättigte Lsg. B =1:1) [nach <bib id=Vogt.etal:1993/>]'' | |||
|- | |||
|bgcolor = "#F0F0F0" align=center| | |||
|bgcolor = "#F0F0F0" align=center| '''Ca(NO<sub>3</sub>)<sub>2</sub>''' | |||
|bgcolor = "#F0F0F0" align=center| '''KNO<sub>3</sub>''' | |||
|- | |||
|bgcolor = "#FFFFEO" align=center| '''MgSO<sub>4</sub> xH<sub>2</sub>O''' | |||
|bgcolor = "#FFFFEO" align=center| 67 (21°C) | |||
|bgcolor = "#FFFFEO" align=center| 78(21°C) | |||
|} | |||
<br clear="all"> | |||
===Feuchtesorption=== | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | |||
|+''Tabelle 3:Sorptionsverhalten von Magnesiumsulfat [nach <bib id=Vogt.etal:1993/>]'' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Lagerungsfeuchte''' | |||
|bgcolor = "#F0F0F0"| '''87%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''81%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''70%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''61%r.F.''' | |||
|bgcolor = "#F0F0F0"| '''50%r.F.''' | |||
|- | |||
|bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub>''' | |||
|bgcolor = "#FFFFEO" align=center| 76 | |||
|bgcolor = "#FFFFEO" align=center| 75 | |||
|bgcolor = "#FFFFEO" align=center| 70 | |||
|bgcolor = "#FFFFEO" align=center| 71 | |||
|bgcolor = "#FFFFEO" align=center| 27 | |||
|- | |||
|bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub> + NaCl'''<br>(1:1 molare Mischung) | |||
|bgcolor = "#FFFFEO" align=center| 240 | |||
|bgcolor = "#FFFFEO" align=center| 146 | |||
|bgcolor = "#FFFFEO" align=center| 75 | |||
|bgcolor = "#FFFFEO" align=center| 50 | |||
|bgcolor = "#FFFFEO" align=center| 20 | |||
|} | |||
<br clear="all"> | |||
<!-- | |||
== Kristallisationsdruck == | |||
Aufgrund der leichten Löslichkeit des Salzes treten bei entsprechenden Feuchteverhältnissen Lösungs- und Rekristallisationsvorgänge ein. Der dabei (theoretisch berechenbare) Kristallisationsdruck liegt bei Epsomit zwischen 10,5-12,5 N/mm<sup>2 </sup>und bei [[Hexahydrit]] zwischen 11,8- 14,1 N/mm<sup>2</sup>. Im Vergleich mit anderen bauschädlichen Salzen liegen diese Werte somit im unteren Drittel einer berechneten Werteskala, die insgesamt von 7,2 bis 65,4 N/mm<sup>2</sup> reicht [nach <bib id=Winkler:1975/>] | |||
== Hydratationsverhalten == | |||
Das System MgSO<sub>4</sub> – H<sub>2</sub>O: Als stabile Verbindungen sind die oben aufgelisteten sechs Hydratstufen des Magnesiumsulfates belegt. Mit der Ausnahme des Magnesiumsulfat-12-Hydrates wurden alle oben aufgeführten Kristallwasserstufen des Magnesiumsulfates an Baudenkmalen nachgewiesen, wobei im wesentlichen jedoch nur Epsomit, [[Hexahydrit]], [[Pentahydrit]] und [[Kieserit]] auftreten. | |||
Epsomit stellt bei Raumtemperatur und einer relativen Feuchte im Bereich von 50%-90% die beständigste Hydratstufe dar. Sinkt die relative Feuchte bei Raumtemperatur deutlich unter 50%, dann kommt es zu Kristallwasserabgabe und der Bildung niedrigerer Hydratstufen. [[Hexahydrit]] (MgSO<sub>4</sub><sub></sub> × 6H<sub>2</sub>O) ist als Reinsalz theoretisch nur im Temperaturbereich zwischen ca. 48°C und 67,5 °C stabil. [[Pentahydrit]] wird in der Literatur als an der Luft metastabil, bzw. instabil bezeichnet, trotzdem ist die Existenz dieser beiden Salzphasen an Bauwerken röntgenografisch nachgewiesen. Das Austreiben des Hydratwassers bis zum Erhalt von [[Kieserit]] kann bei erhöhten Temperaturen stattfinden. | |||
== Hydratationsdruck == | |||
Die Möglichkeit der Veränderung des Kristallwassergehaltes von Magnesiumsulfaten an Bauwerken ist erwiesen, und es ist anzunehmen, dass Wechsel im Bereich der Kristallwasserstufen [[Pentahydrit]], [[Hexahydrit]] und Epsomit (in Abhängigkeit von klimatischen Veränderungen) in situ durchlaufen werden. Der Einbau eines Wassermoleküles in das Kristallgitter des [[Hexahydrit]] und der Umbildung zu Epsomit ist mit einer Volumenzunahme von rund 10% verbunden. Der daraus resultierende Hydratationsdruck kann bei einer Temperatur von 0-20°C und einer r.F. von ca. 70% mit Werten zwischen 6,8 –9,7 N/mm<sup>2</sup> angegeben werden. Für die Umwandlung von [[Kieserit]] zu [[Hexahydrit]] ist eine Volumenzunahme von ca. 140% anzugeben [nach <bib id=Stark.etal:1996/>]. | |||
== Umwandlungsreaktionen == | |||
Als Beispiel für das Schädigungspotential, das mit der Bildung von Epsomit verbunden ist, sei ein Fall dargestellt: Liegt Magnesiumcarbonat (als [[Magnesit]]) im Materialgefüge eines Denkmales vor, so kann durch die Einwirkung von Schwefelsäure Epsomit entstehen. Mit dieser Umwandlung ist eine Volumenzunahme von über 400% verbunden nach <bib id=Stark.etal:1996/>. | |||
<br> | |||
<br> | |||
== Analytischer Nachweis == | |||
Kristallisiertes Magnesiumsulfat, welches an einem Objekt vorliegt, kann in unterschiedlichen Morphologien erscheinen, wobei bestimmte Erscheinungsformen vorzugsweise auftreten. Bei einem im Rahmen der Diplomarbeit von Mainusch <bib id= Mainusch:2001/> untersuchten Objekt stellte sich die Ausbildung eines Gemisches von Epsomit und [[Hexahydrit]] in situ als lockere Kruste einer opaken, grauweißlichen Substanz dar. In Form “körniger Krusten” ist Epsomit in der Klosterkirche St. Johann in Müstair belegt, Magnesiumsulfatausblühungen in Form von Salz-Whiskern wurden in der St. Georgskirche in der Steiermark in Österreich nachgewiesen. | |||
--> | |||
<!-- | |||
=== Mikrochemie === | |||
--> | |||
<!-- | |||
=== Mikroskopie === | |||
'''Laboruntersuchung:''' | |||
Behauchen einer überwiegend magnesiumsulfathaltigen Ausblühung bewirkt keine makroskopisch beobachtbaren Veränderungen. Charakteristisch hingegen ist das gute Lösungsverhalten in Wasser, ein pH-Wert um 7 und die Ausbildung eines mit bloßem Auge erkennbaren, ringförmigen und leicht erhabenen Saumes bzw. einer transparenten Schicht, die nach dem Verdampfen des wässrigen Lösemittels verbleibt. | |||
Im Labor sind die Ergebnisse der Objekttests unter Zuhilfenahme des Mikroskops zu überprüfen. Die Betrachtung einerseits des Rohprobematerials, wie auch des rekristallisierten Salzes zeigt: Magnesiumsulfatkristalle treten im Probematerial in sehr unspezifischen Erscheinungsformen auf. Versuche, gut ausgebildete Magnesiumsulfat-Einzelkristalle auf dem Wege der Rekristallisation aus wässriger Lösung zu erstellen, erweisen sich als sehr schwierig, da eine starke Verwachsungstendenz besteht. So bildet sich in der Regel der erwähnte auffällige, ringförmige Saum von flach ineinander verwachsenen Kristallen, wenn eine überwiegend magnesiumsulfathaltige Lösung vorsichtig eingedampft wird. Epsomit zeigt eine geringe Löslichkeit in wasserfreiem Ethanol und in Glyzerin, was unter dem Mikroskop gut zu beobachten ist. | |||
Die Tendenz von Magnesiumsulfat, beim Rekristallisieren aus wässriger Lösung kaum äquidimensionale oder elongierte Einzelkristalle auszubilden, erschwert die Erstellung guter Präparate für die weitergehende [[Polarisationsmikroskopie|polarisationsmikroskopische]] Untersuchung beträchtlich. Die geringe Ethanollöslichkeit ermöglicht es allerdings, durch sehr dosierte, eventuell mehrfache Zugabe auf das rekristallisierte Material Einzelpartikel zu isolieren. Sowohl am Ausgangsmaterial, wie auch am rekristallisierten Präparat ist die weiterfolgende Untersuchung am [[polarisationsmikroskopie|Polarisationsmikroskop]] durchzuführen.<br> | |||
'''Brechungsindizes''': n<sub>X</sub> = 1,433, n<sub>y</sub> = 1,455, n<sub>z</sub> <br> | |||
'''Doppelbrechung: '''Δ = max. 0,028 <br> | |||
'''Kristallklasse:''' orthorhombisch | |||
<br> | |||
<br> | |||
'''[[Polarisationsmikroskopie|Polarisationsmikroskopische Untersuchung:]]'''<br> | |||
Die Zuweisung der Brechungsindizes von Epsomit erfolgt entsprechend der Immersionsmethode (sukzessive mittels der Einbettmedien n<sub>D</sub>=1,518; n<sub>D</sub>=1,47; n<sub>D</sub>=1,46). Bei der Verwendung eines Immersionsmediums mit Brechungsindex n<sub>D</sub>=1,45 ist bei vielen Einzelpartikeln ein geringer, jedoch klarer Wechsel im Relief bei der Rotation erkennbar. Da Epsomit zur Klasse der orthorhombischen Kristalle zählt, tritt keine schiefe, sondern stets parallele und symmetrische Auslöschung auf. Neben Epsomit bildet sich zumeist auch Hexahydrit, welches monoklin ist und nahezu identische Brechungsindizes wie Epsomit aufweist. Zwischen diesen beiden Hydratformen des Magnesiumsaulfates ist eine Unterscheidung nur über die Zuweisung der Kristallklasse möglich. Aufgrund des geringen Gangunterschiedes zeigen Epsomitkristalle in der Regel nur niedrige Interferenzfarben im Bereich der ersten Ordnung. | |||
'''Verwechslungsmöglichkeiten:'''<br> | |||
Epsomit/[[Hexahydrit]] sind zuzuweisen, sofern die unteren Untersuchungskriterien eindeutig geklärt sind: | |||
*gute Wasserlöslichkeit | |||
*charakteristisches Erscheinungsbild bei der Rekristallisation | |||
*geringe Doppelbrechung | |||
<br> | |||
--> | |||
<!-- | |||
== Röntgendiffraktometrie == | |||
== Raman-Stektroskopie == | |||
== DTA / TG == | |||
== IR-Spektroskopie == | |||
= <br>Umgang mit Epsomitschäden = | |||
--> | |||
== Salts and deteriation pattern == | |||
=== t the objects === | |||
=== Under the polarizing microscope === | |||
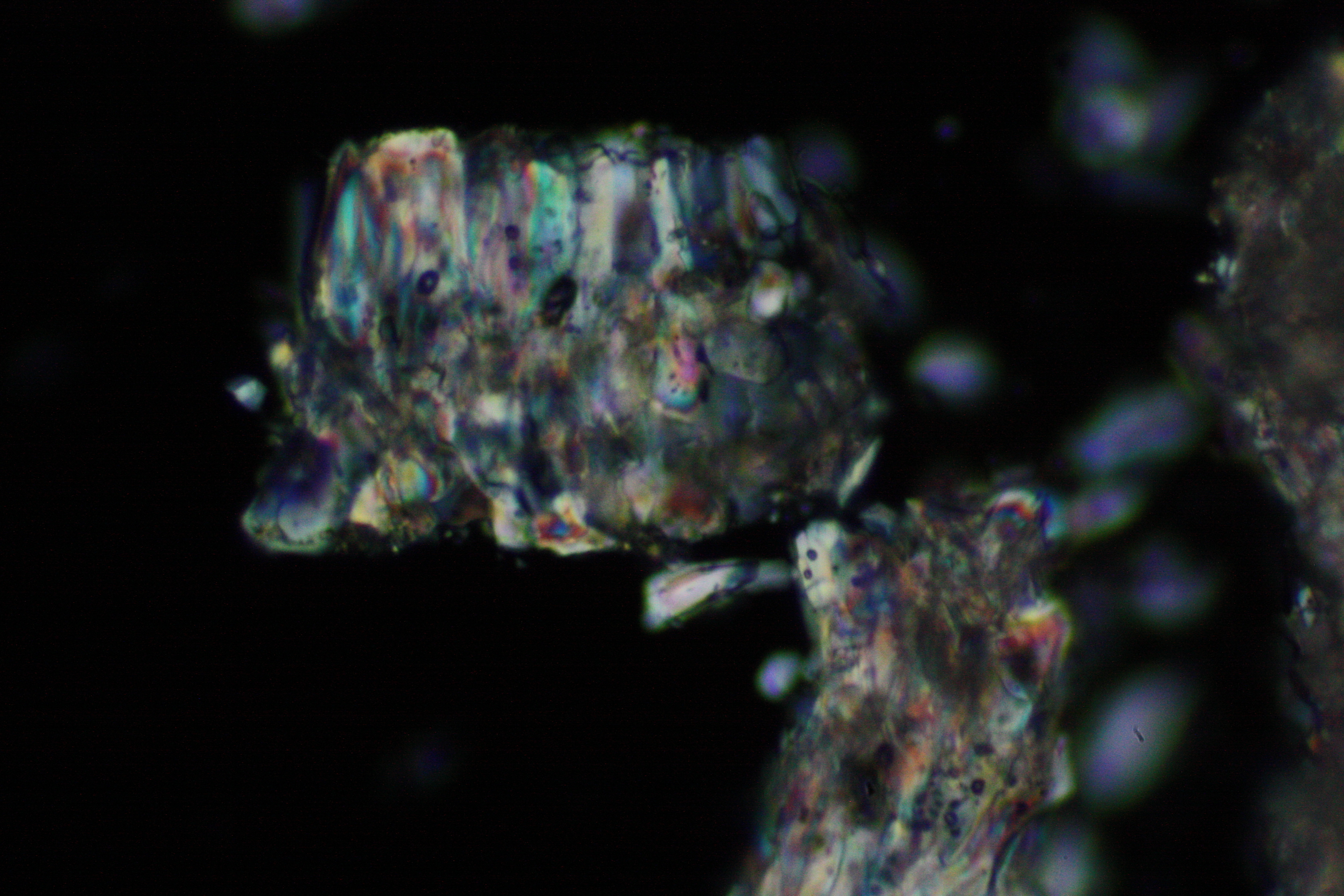
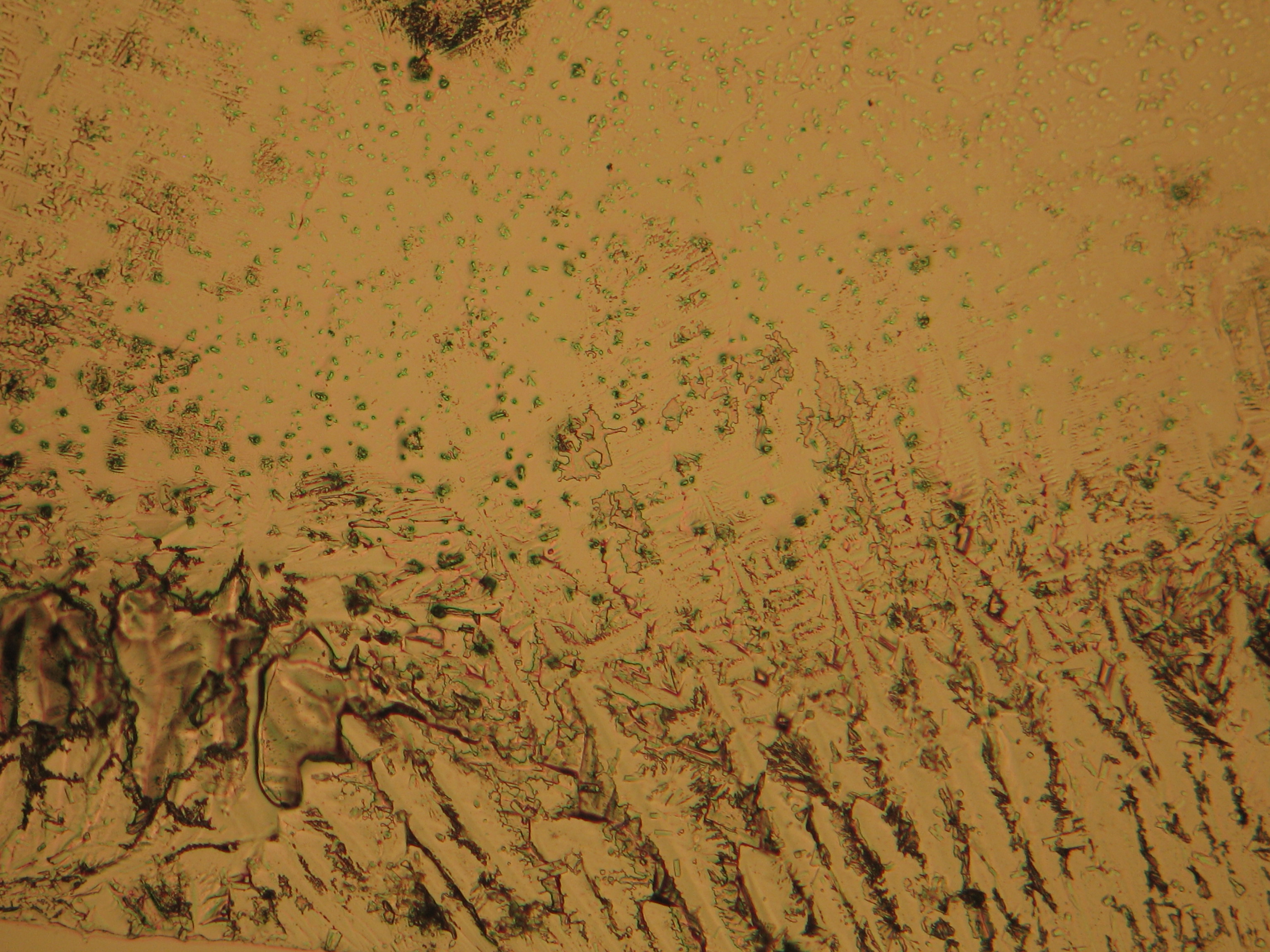
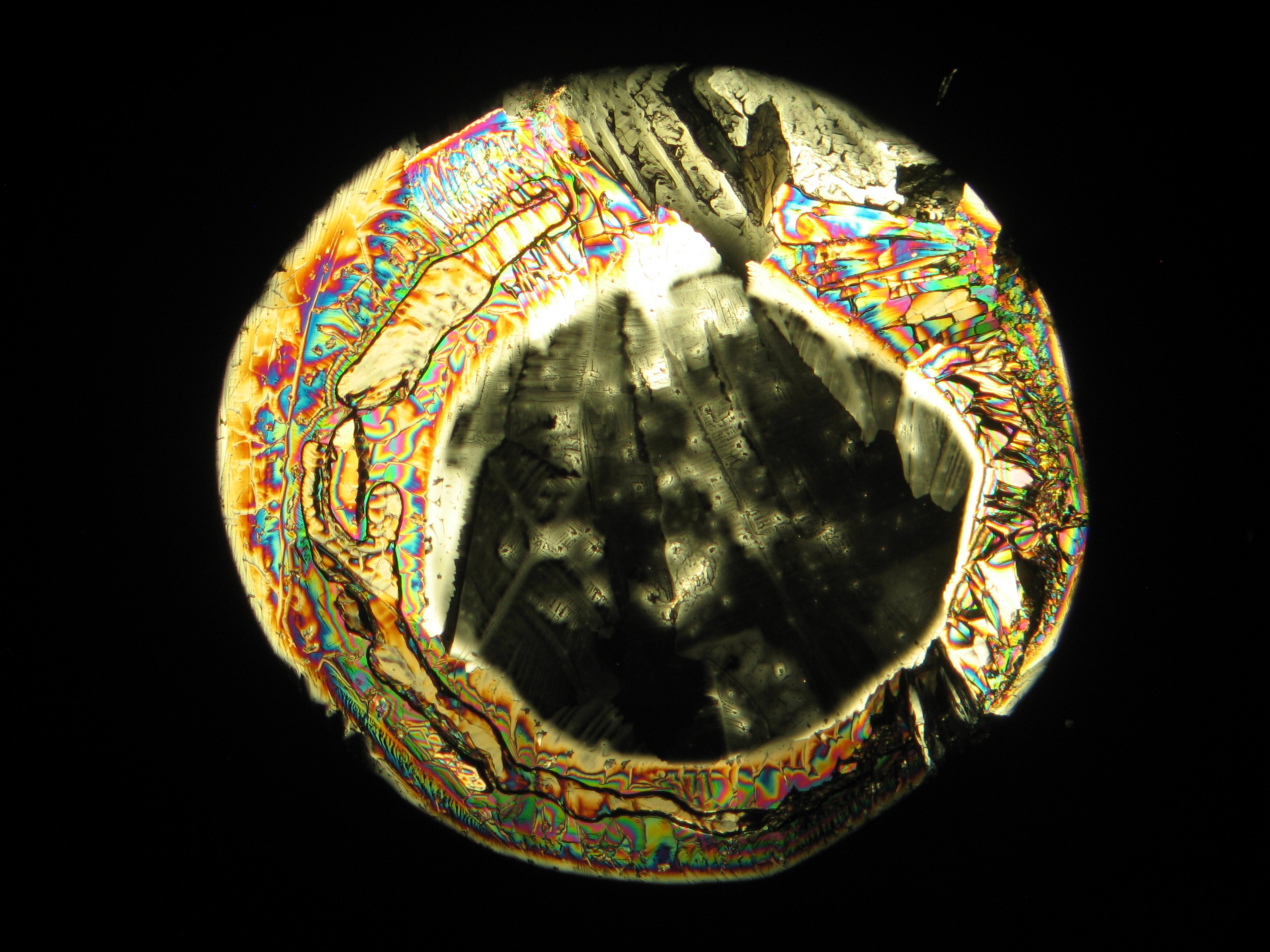
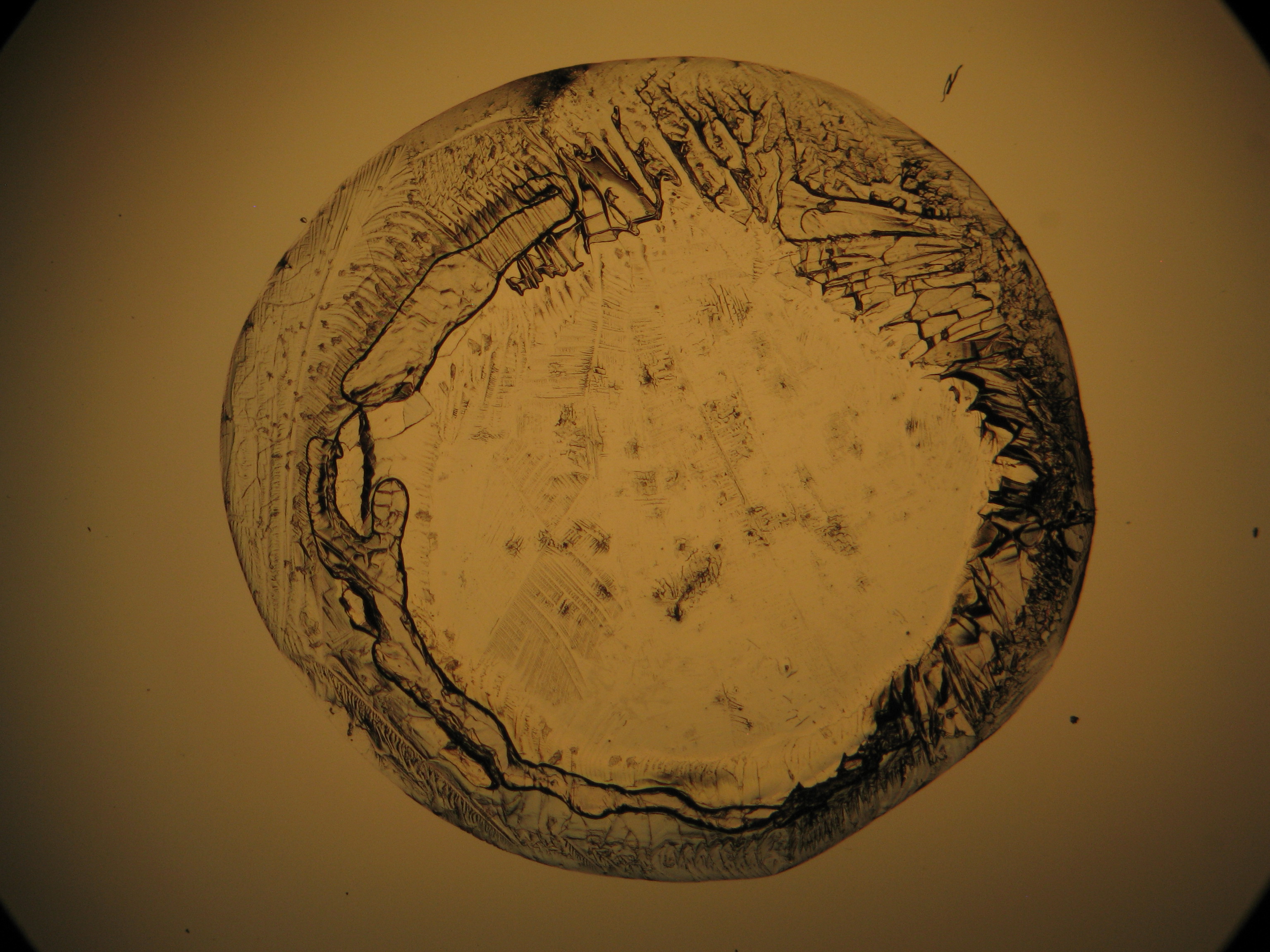
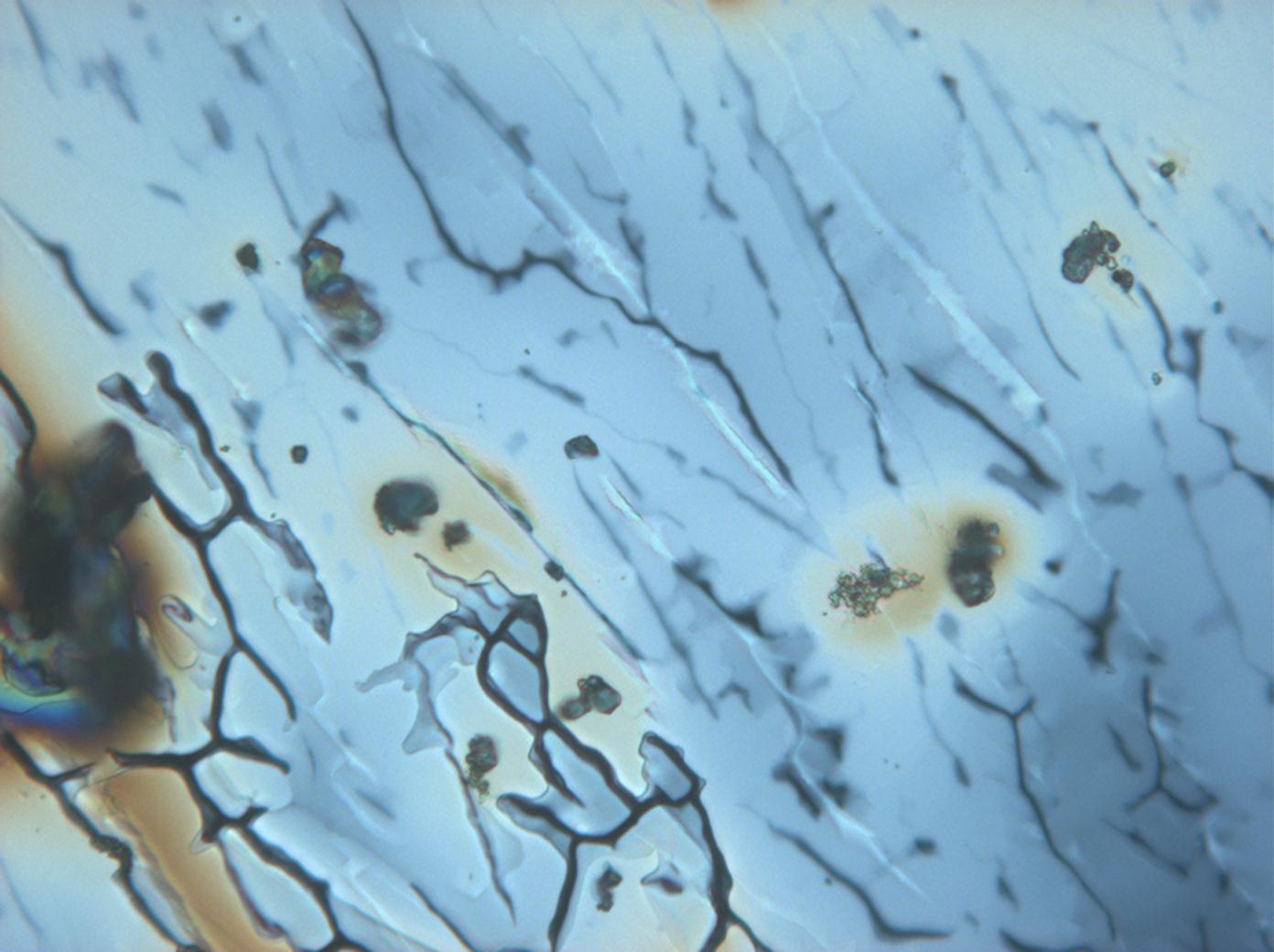
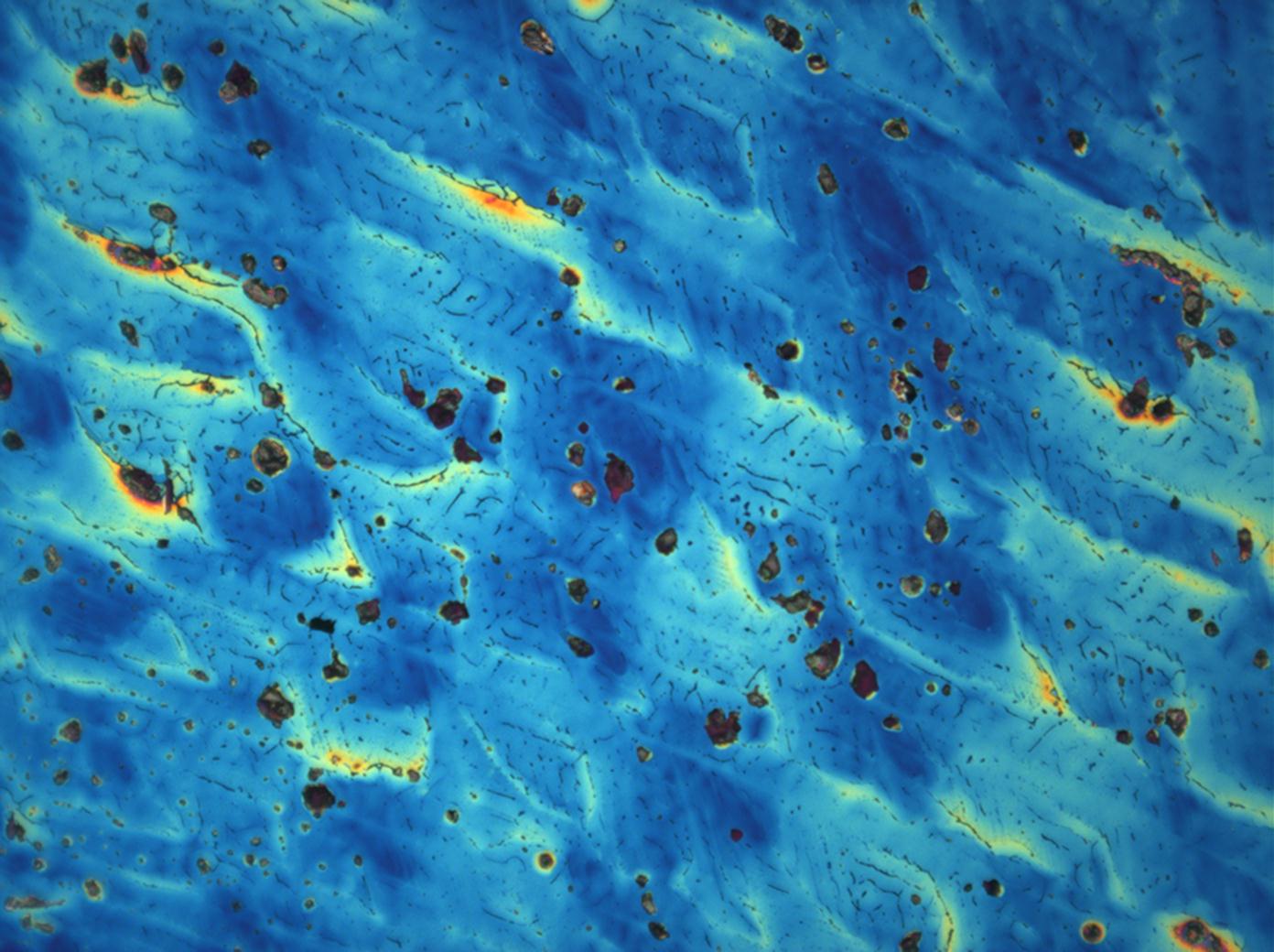
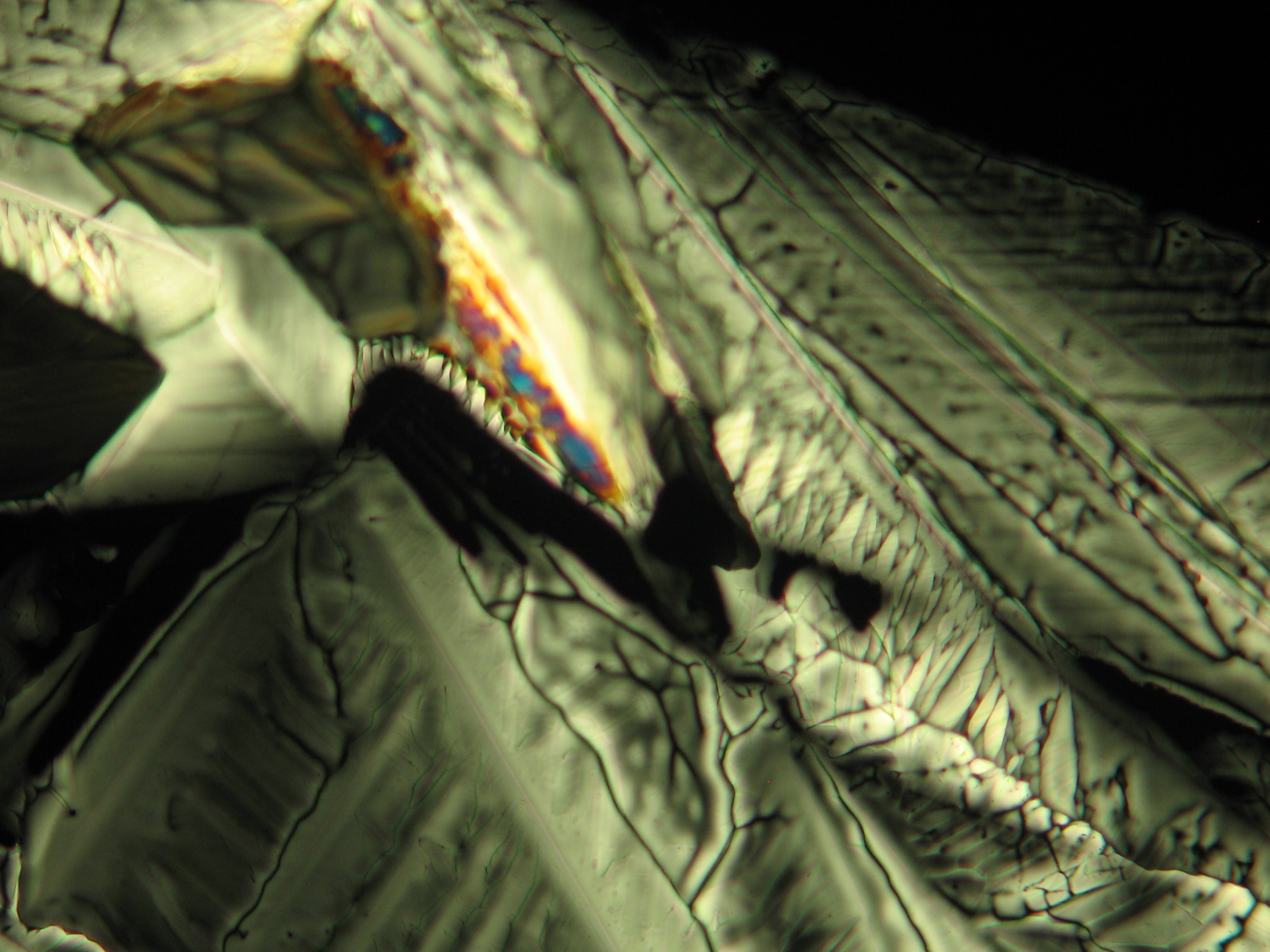
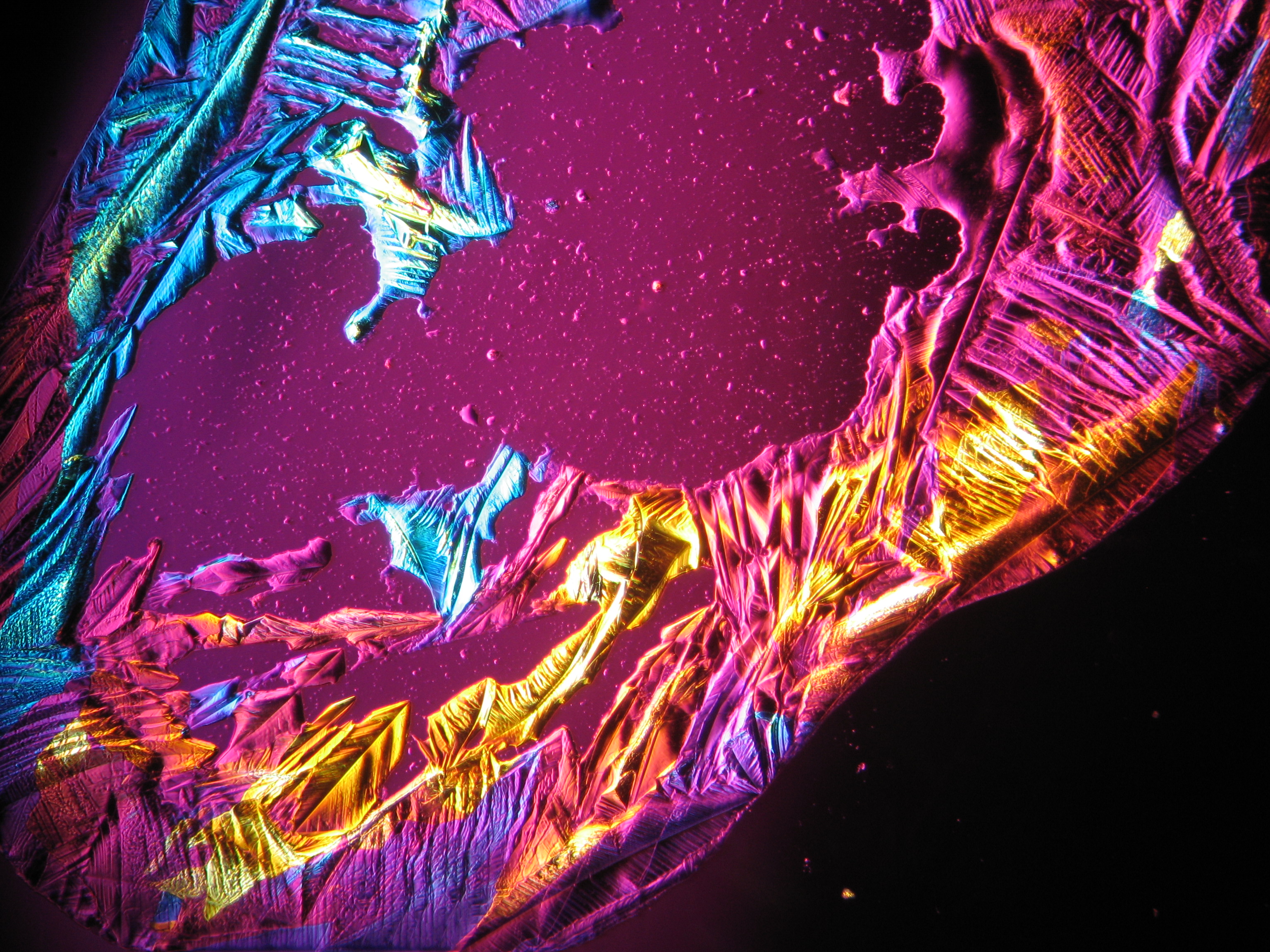
<gallery caption="Crystallized from a water solution on a glass slide " widths="200px" heights="150px" perrow="3"> | |||
Image:0141 0010 Bb440um 0021.JPG|Sampole of a salt crust of magnesium sulfate whiskers | |||
Image:CeS 221209-02-10x-01.JPG|Real sample with magnesium sulfate salts, crystallized from a water solution on a glass slide | |||
Image:CeS 221209-02-10x-02.JPG|Real sample with magnesium sulfate salts, crystallized from a water solution on a glass slide | |||
Image:CeS 221209-04-2,5kx-01.JPG|Real sample with magnesium sulfate salts, crystallized from a water solution on a glass slide | |||
Image:CeS 221209-04-2,5kx-02.JPG|Real sample with magnesium sulfate salts, crystallized from a water solution on a glass slide | |||
Image:CeS 221209-04-2,5kx-03.JPG|Real sample with magnesium sulfate salts, crystallized from a water solution on a glass slide | |||
Image:HJS MgSO4 092503-1.jpg|Kieserite-crystals | |||
Image:HJS MgSO4 092503-2.jpg|Kieserite-crystals | |||
Image:HJS MgSO4 092503-3.jpg|Kieserite-crystals | |||
Image:HJS MgSO4 092503-5.jpg|Kieserite-crystals | |||
Image:HJS MgSO4 092503-8.jpg|Kieserite-crystals | |||
Image:HJS MgSO4 092503-9.jpg|Kieserite-crystals | |||
Image:MGSO4 4.5.2006 (11).JPG|Magnesium- ulfate, crystallized from a water solution on a glass slide | |||
Image:MGSO4 4.5.2006 (12).JPG|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:MGSO4 4.5.2006 (3).JPG|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:Magnesiumsulfat pol 01.jpg|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:MgSO4 pol 400x 01.JPG|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:MgSO4 pol+analy 400x 01.JPG|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:MgSO4 pol+analy+rotII 400x 01.JPG|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
Image:MgSO4 pol+analy.jpg|Magnesium sulfate, crystallized from a water solution on a glass slide | |||
</gallery> | |||
<!-- | |||
== Unter dem Rasterelektronenmikroskop == | |||
--> | |||
==Weblinks== | ==Weblinks== | ||
Revision as of 15:50, 26 December 2011
| Epsomite[1][2] | |

| |
| Mineralogical name | Epsomite |
| Chemical name | Magnesiumsulfate Heptahydrate |
| Trivial name | Bitter Salts, Reichardtite, Seelandite |
| Chemical formula | MgSO4•7H2O |
| Other forms | Kieserite (MgSO4•H2O) Sanderite (MgSO4•2H2O) Starkeyite (MgSO4•4H2O) Pentahydrite(MgSO4•5H2O) Hexahydrite (MgSO4•6H2O) Meridianite (MgSO4•11H2O) Magnesium 12-Hydrate |
| Crystal system | orthorhombic |
| Crystal structure | |
| Deliquescence humidity 20°C | 90.1% (20°C), 94% (30°C) |
| Solubility (g/l) at 20°C | 710 g/l |
| Density (g/cm³) | 146.8 cm3/mol |
| Molar volume | 246.48 g/mol |
| Molar weight | 1.67 g/cm3 |
| Transparency | transparent to translucent |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | can by produced from an aqueous solution under 50°C |
| Crystal Optics | |
| Refractive Indices | nx = 1.433 ny = 1.455 nz = 1.461 |
| Birefringence | Δ = 0.028 |
| Optical Orientation | biaxial negative |
| Pleochroism | |
| Dispersion | |
| Used Literature | |
| {{{Literature}}} | |
<bibimport/>
Authors: Hans-Jürgen Schwarz, Tim Müller, Nils Mainusch
back to Sulfate
Hygroskopicity[edit]
| 10°C | 20°C | 25°C | 30°C |
| 86,9% r.F. | 90,1% r.F. | 88,3% r.F. | 88,0% r.F. |
| Ca(NO3)2 | KNO3 | |
| MgSO4 xH2O | 67 (21°C) | 78(21°C) |
Feuchtesorption[edit]
| Lagerungsfeuchte | 87%r.F. | 81%r.F. | 70%r.F. | 61%r.F. | 50%r.F. |
| MgSO4 | 76 | 75 | 70 | 71 | 27 |
| MgSO4 + NaCl (1:1 molare Mischung) |
240 | 146 | 75 | 50 | 20 |
Salts and deteriation pattern[edit]
t the objects[edit]
Under the polarizing microscope[edit]
- Crystallized from a water solution on a glass slide
Weblinks[edit]
- ↑ http://webmineral.com/data/Epsomite.shtml seen on 29.072010
- ↑ http://www.mindat.org/min-1393.html seen on 29.072010