Epsomite: Difference between revisions
Jump to navigation
Jump to search
No edit summary |
|||
| Line 62: | Line 62: | ||
<br> | <br> | ||
== | == Hygroscopicity == | ||
<!-- | <!-- | ||
Die geringe Hygroskopizität des Reinsalzes Epsomit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich 88-90 % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunkt tiefer (siehe Tab.). Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. <br> | Die geringe Hygroskopizität des Reinsalzes Epsomit, die in dem hohen Wert der Gleichgewichtsfeuchte im Bereich 88-90 % r.F. deutlich wird, kann nicht isoliert betrachtet werden. In Mischsystemen, d.h. unter dem Einfluss von Fremdionen, liegt der Sorptionspunkt tiefer (siehe Tab.). Die Möglichkeit der hygroskopischen Feuchteaufnahme mit den damit verbundenen Problematiken ist trotz des hohen Deliqueszenzpunktes durchaus gegeben. <br> | ||
--> | --> | ||
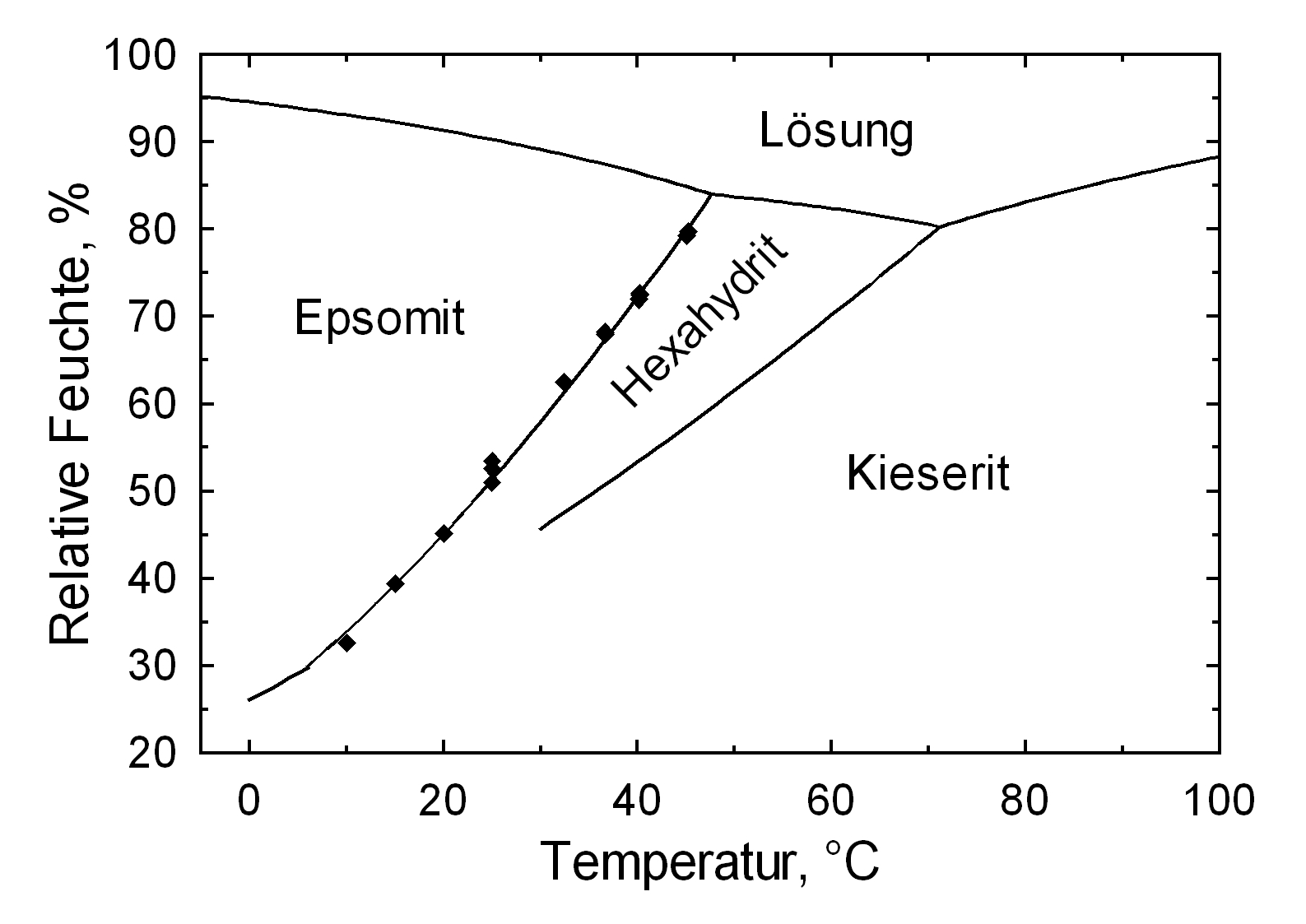
[[file:MgSO4_a.jpg|thumb|350px|right|''' | [[file:MgSO4_a.jpg|thumb|350px|right|'''Figure 2:''' The system MgSO<sub>4</sub>/H<sub>2</sub> form -30°C to 80°C , (Diagram: Michael Steiger)]] | ||
<br clear="all"> | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | {|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable" | ||
|+'' | |+''Table 1:Deliqueszenz points and temperature [after <bib id=Arnold.etal:1991/>]'' <!-- Tabellenüberschrift einfügen --> | ||
|- | |- | ||
|bgcolor = "#F0F0F0" align=center| 10°C | |bgcolor = "#F0F0F0" align=center| 10°C | ||
| Line 81: | Line 81: | ||
|bgcolor = "#FFFFEO" align=center| 88,3% r.F. | |bgcolor = "#FFFFEO" align=center| 88,3% r.F. | ||
|bgcolor = "#FFFFEO" align=center| 88,0% r.F. | |bgcolor = "#FFFFEO" align=center| 88,0% r.F. | ||
|} | |} | ||
<br clear="all"> | <br clear="all"> | ||
=== | ===Sorption of moisture=== | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | {|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | ||
|+'' | |+''Tabele 2: Behavior concerning moisture sorption of magnesium sulfate [after bib id=Vogt.etal:1993/>]'' | ||
|- | |- | ||
|bgcolor = "#F0F0F0"| ''' | |bgcolor = "#F0F0F0"| '''Moisture sorption at''' | ||
|bgcolor = "#F0F0F0"| '''87%r.F.''' | |bgcolor = "#F0F0F0"| '''87%r.F.''' | ||
|bgcolor = "#F0F0F0"| '''81%r.F.''' | |bgcolor = "#F0F0F0"| '''81%r.F.''' | ||
| Line 114: | Line 102: | ||
|bgcolor = "#FFFFEO" align=center| 27 | |bgcolor = "#FFFFEO" align=center| 27 | ||
|- | |- | ||
|bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub> + NaCl'''<br>(1:1 molare | |bgcolor = "#F7F7F7"| '''MgSO<sub>4</sub> + NaCl'''<br>(1:1 molare mixture) | ||
|bgcolor = "#FFFFEO" align=center| 240 | |bgcolor = "#FFFFEO" align=center| 240 | ||
|bgcolor = "#FFFFEO" align=center| 146 | |bgcolor = "#FFFFEO" align=center| 146 | ||
Revision as of 15:54, 26 December 2011
| Epsomite[1][2] | |

| |
| Mineralogical name | Epsomite |
| Chemical name | Magnesiumsulfate Heptahydrate |
| Trivial name | Bitter Salts, Reichardtite, Seelandite |
| Chemical formula | MgSO4•7H2O |
| Other forms | Kieserite (MgSO4•H2O) Sanderite (MgSO4•2H2O) Starkeyite (MgSO4•4H2O) Pentahydrite(MgSO4•5H2O) Hexahydrite (MgSO4•6H2O) Meridianite (MgSO4•11H2O) Magnesium 12-Hydrate |
| Crystal system | orthorhombic |
| Crystal structure | |
| Deliquescence humidity 20°C | 90.1% (20°C), 94% (30°C) |
| Solubility (g/l) at 20°C | 710 g/l |
| Density (g/cm³) | 146.8 cm3/mol |
| Molar volume | 246.48 g/mol |
| Molar weight | 1.67 g/cm3 |
| Transparency | transparent to translucent |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | can by produced from an aqueous solution under 50°C |
| Crystal Optics | |
| Refractive Indices | nx = 1.433 ny = 1.455 nz = 1.461 |
| Birefringence | Δ = 0.028 |
| Optical Orientation | biaxial negative |
| Pleochroism | |
| Dispersion | |
| Used Literature | |
| {{{Literature}}} | |
<bibimport/>
Authors: Hans-Jürgen Schwarz, Tim Müller, Nils Mainusch
back to Sulfate
Hygroscopicity[edit]
| 10°C | 20°C | 25°C | 30°C |
| 86,9% r.F. | 90,1% r.F. | 88,3% r.F. | 88,0% r.F. |
Sorption of moisture[edit]
| Moisture sorption at | 87%r.F. | 81%r.F. | 70%r.F. | 61%r.F. | 50%r.F. |
| MgSO4 | 76 | 75 | 70 | 71 | 27 |
| MgSO4 + NaCl (1:1 molare mixture) |
240 | 146 | 75 | 50 | 20 |
Salts and deteriation pattern[edit]
t the objects[edit]
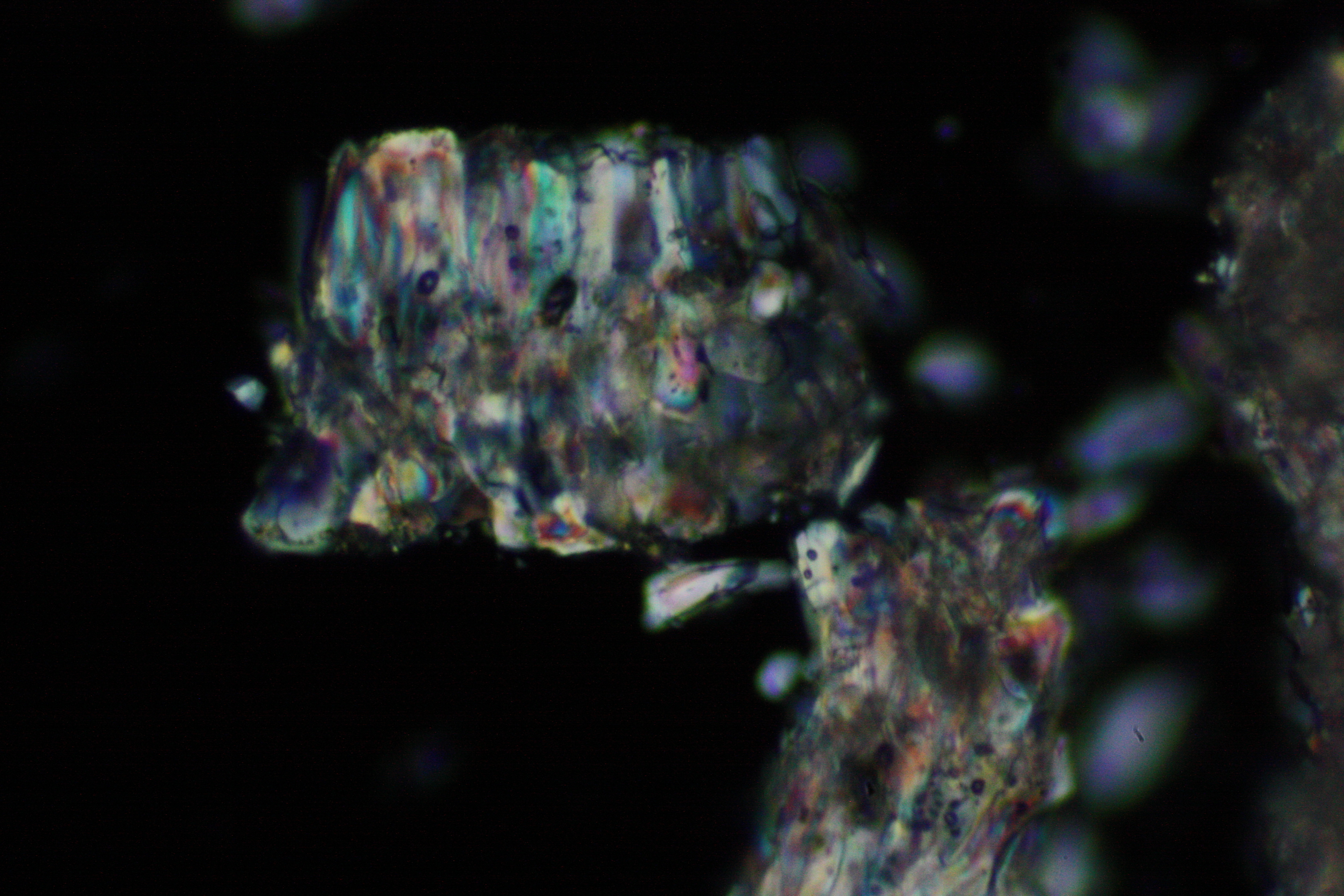
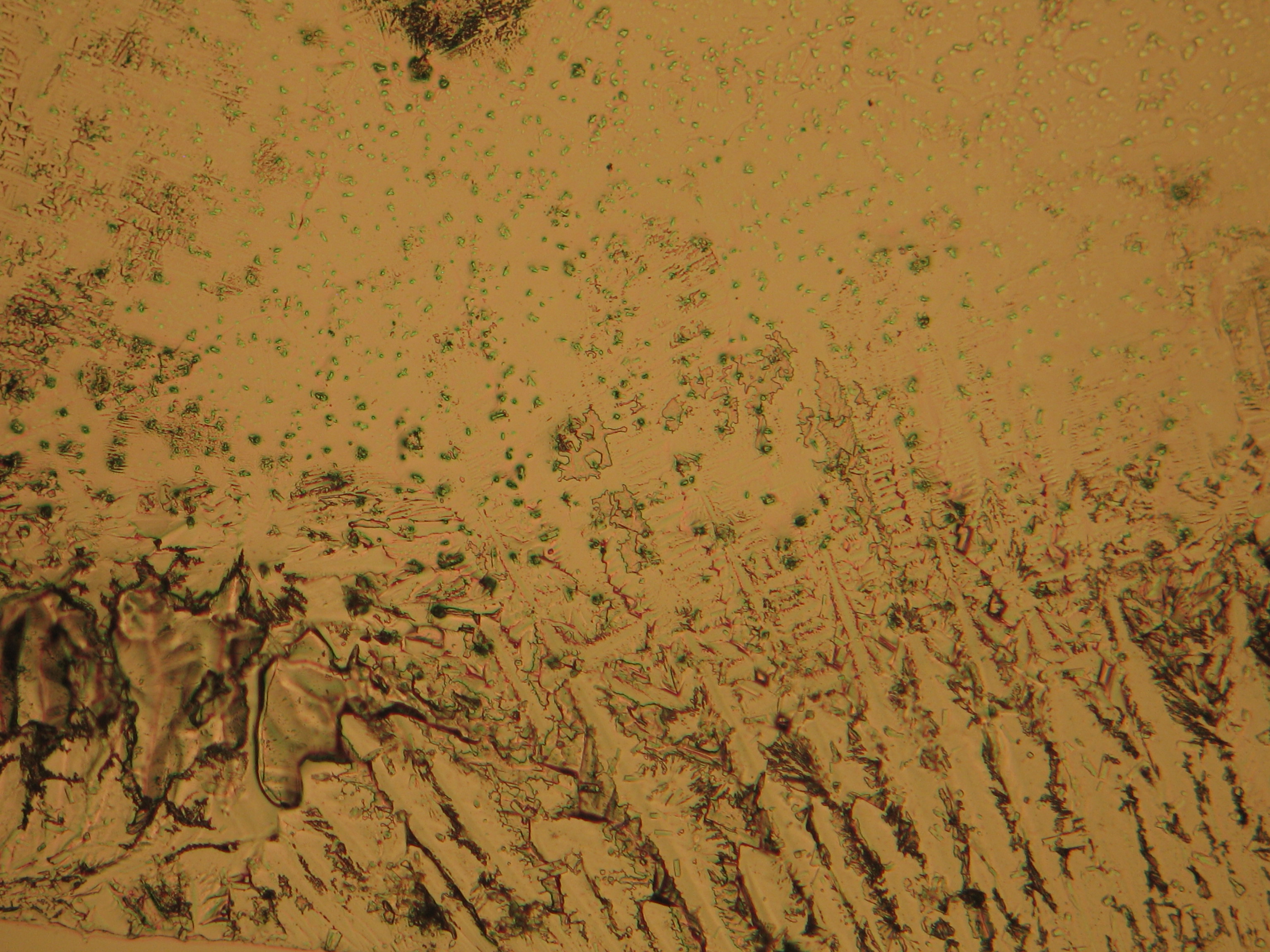
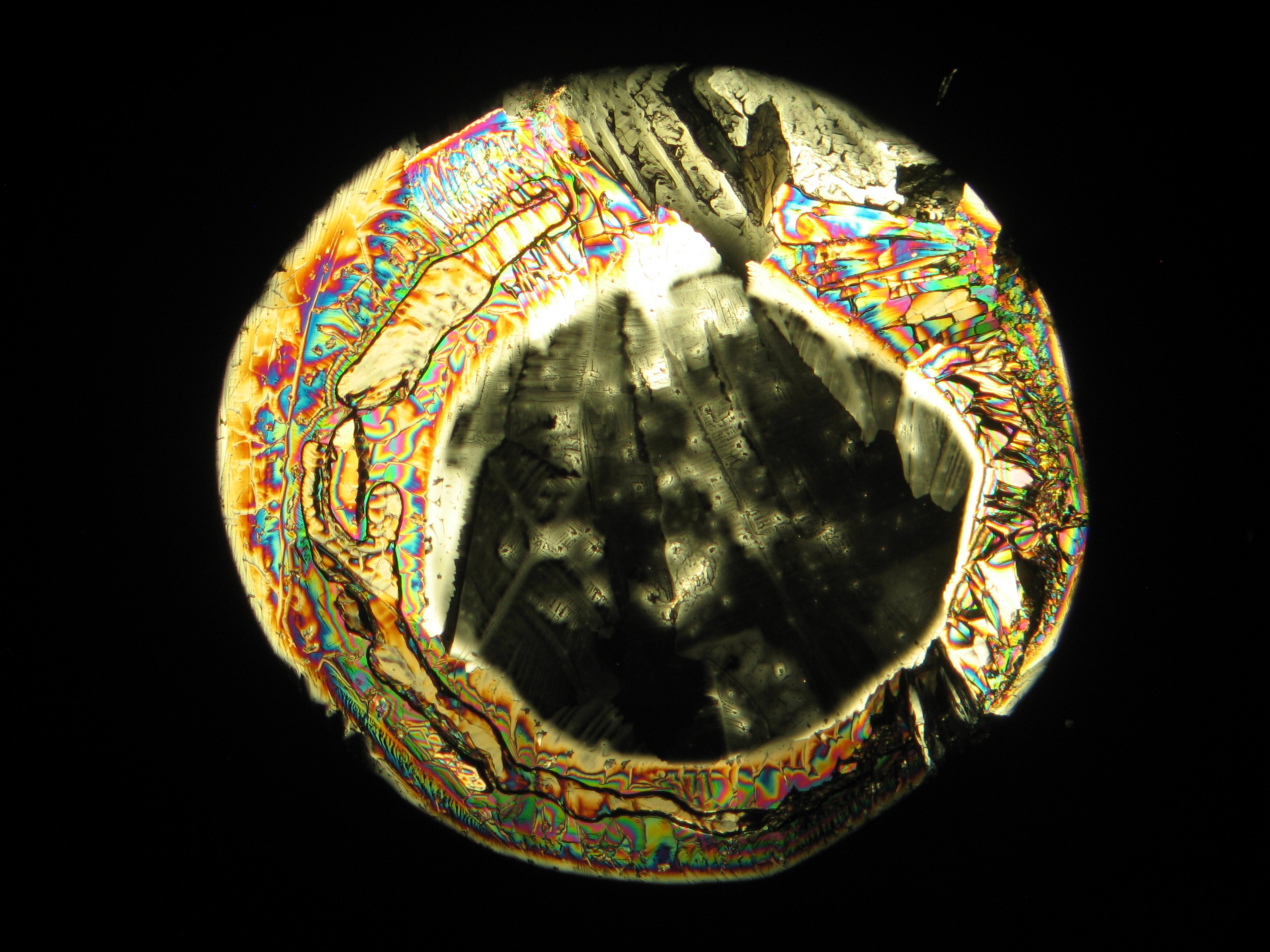
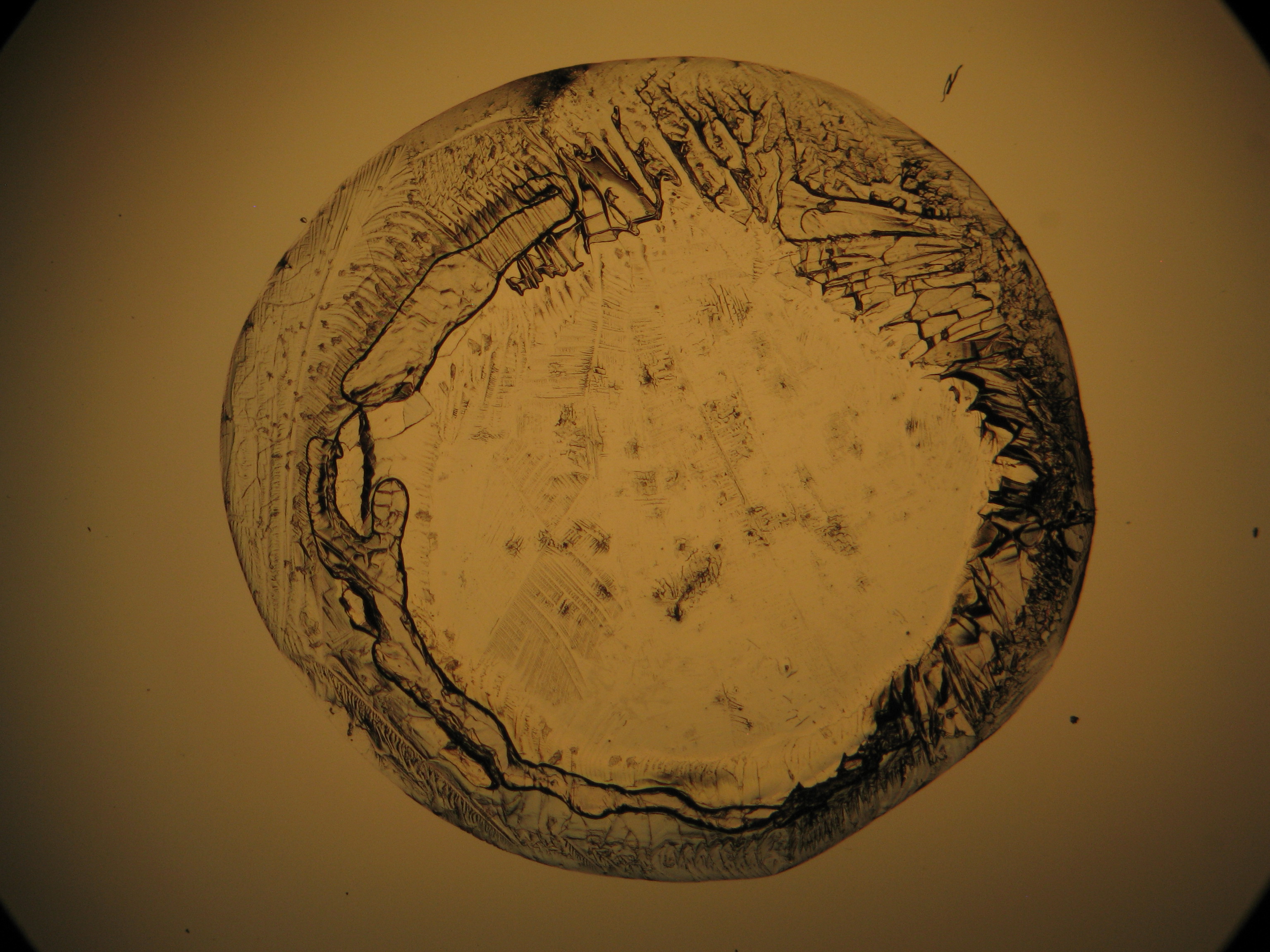
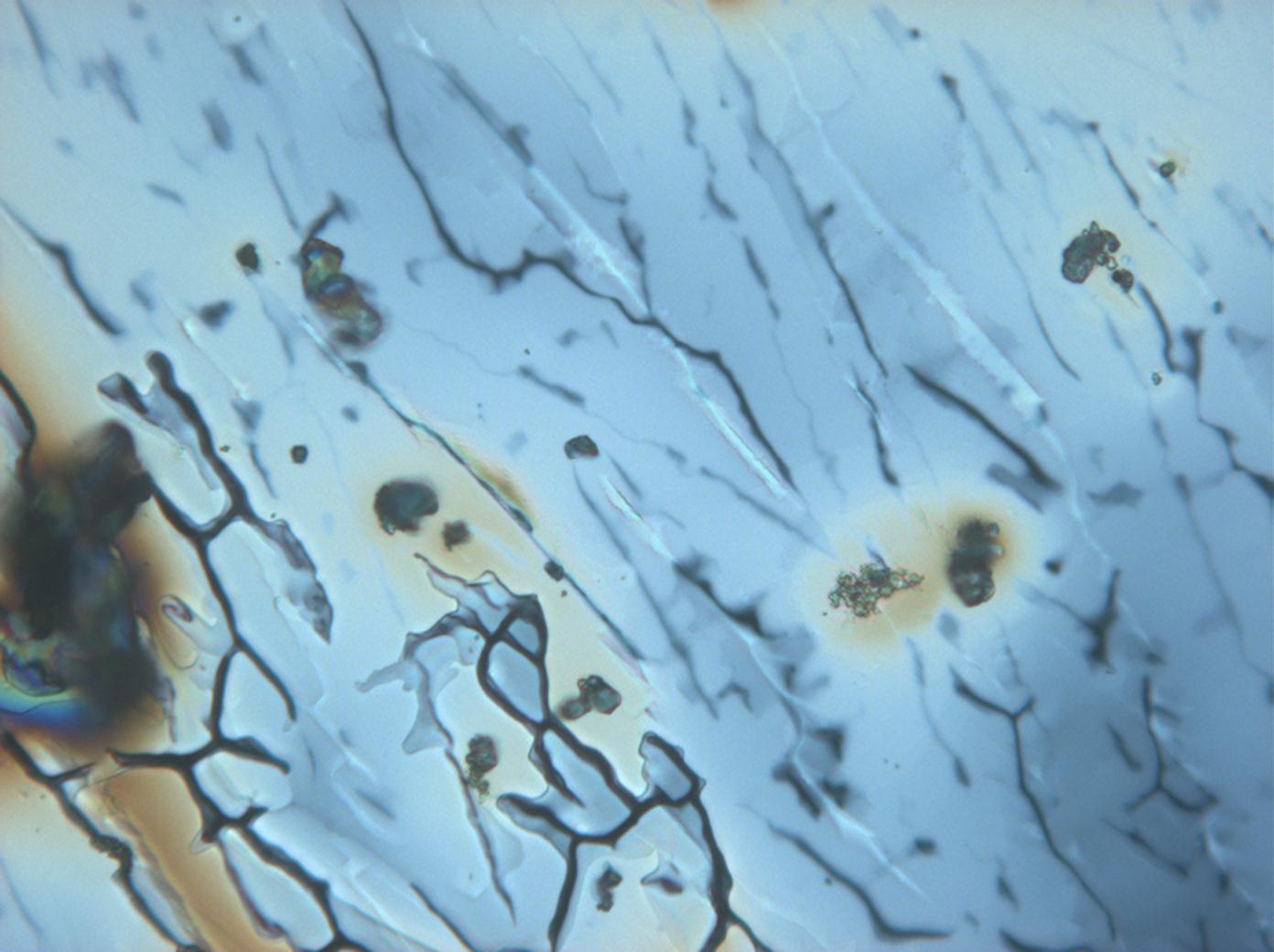
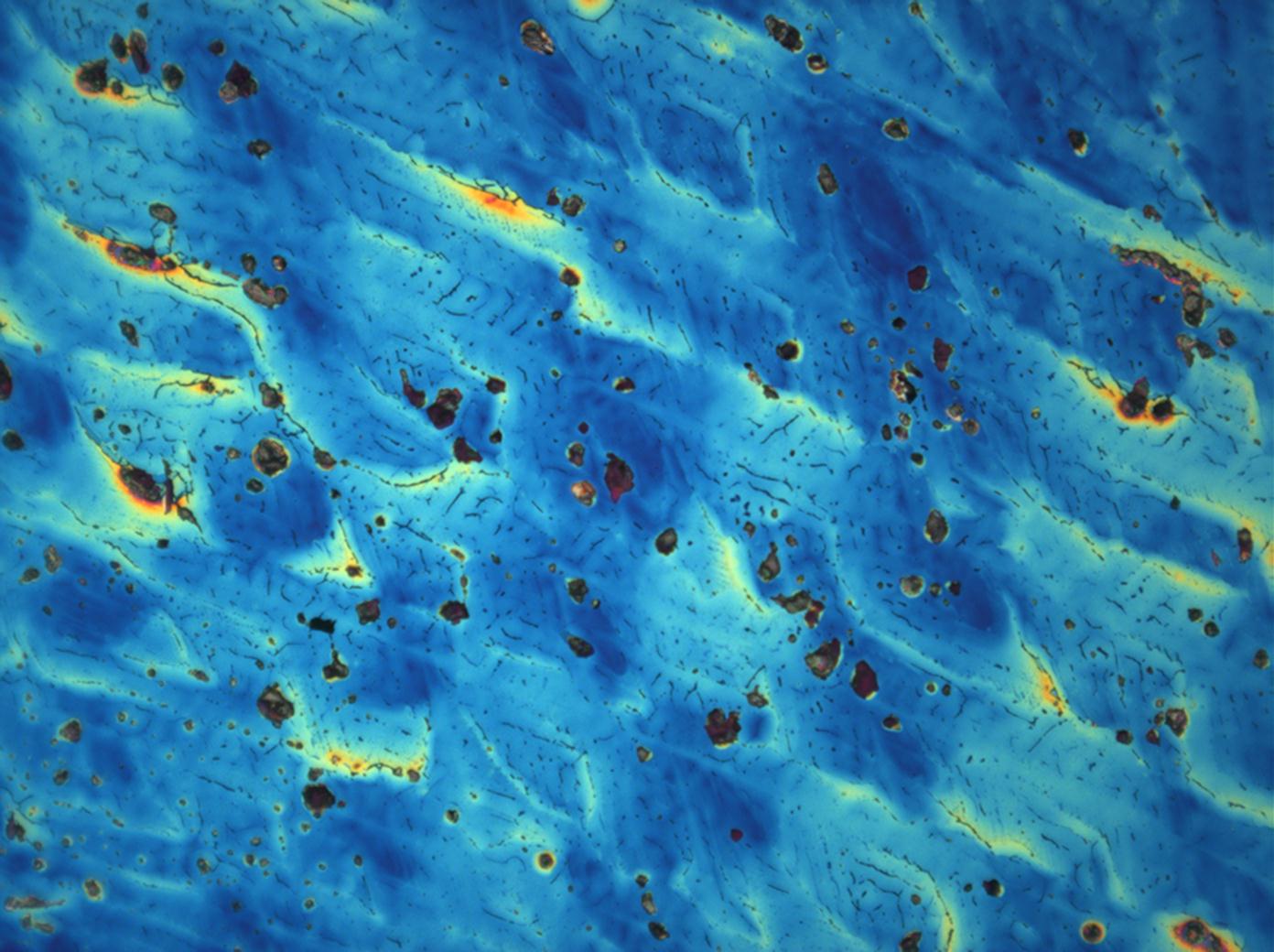
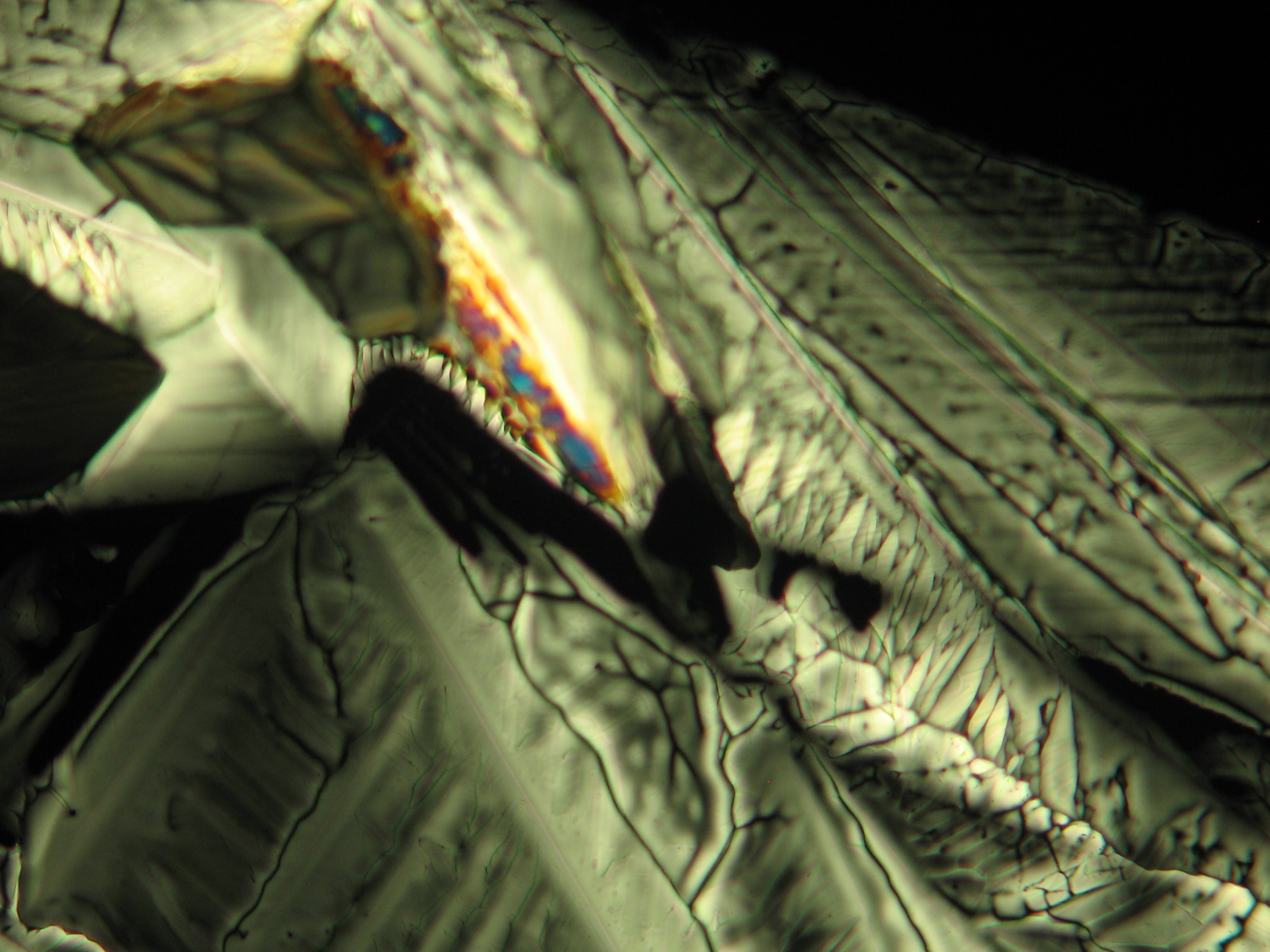
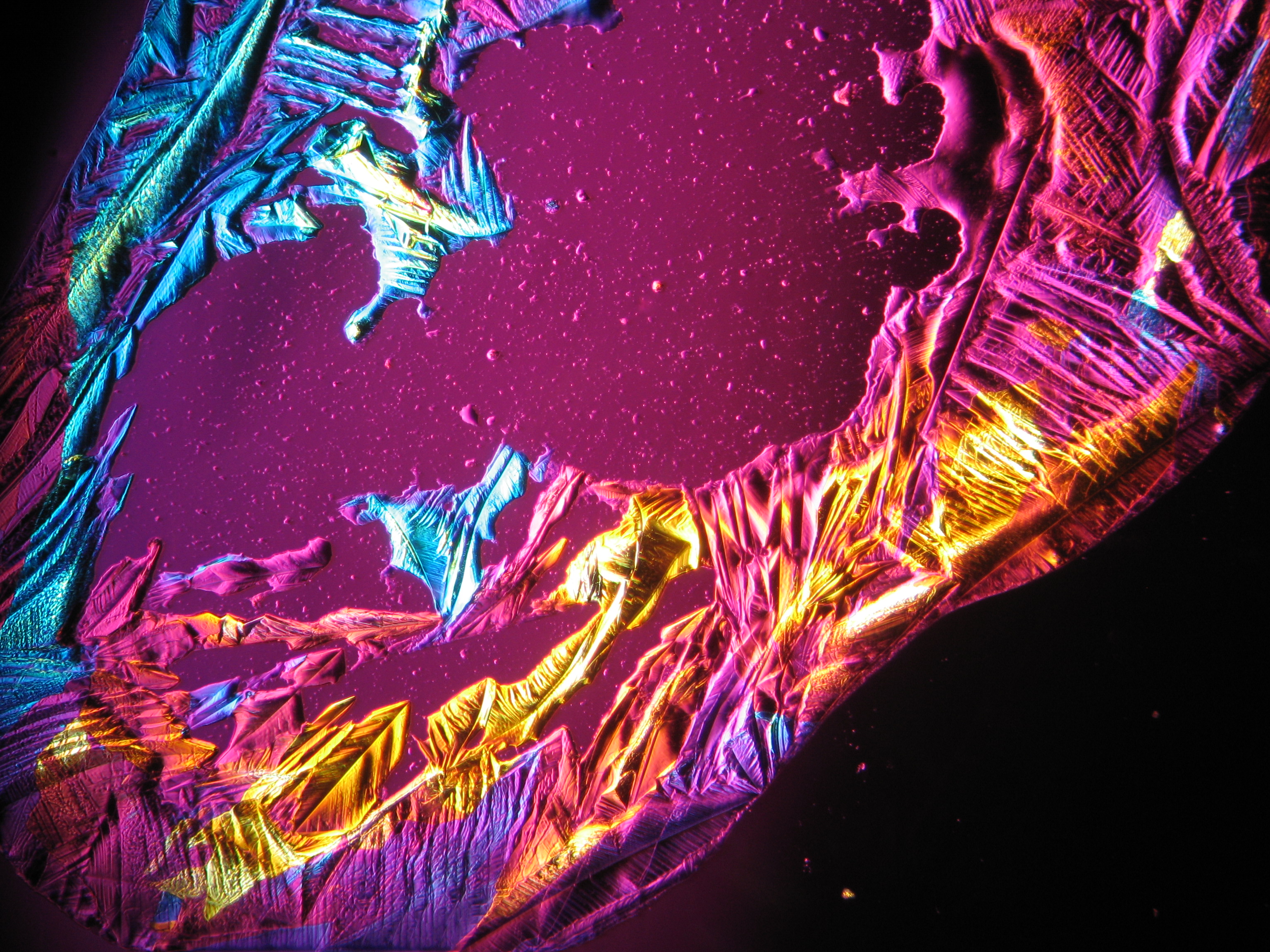
Under the polarizing microscope[edit]
- Crystallized from a water solution on a glass slide
Weblinks[edit]
- ↑ http://webmineral.com/data/Epsomite.shtml seen on 29.072010
- ↑ http://www.mindat.org/min-1393.html seen on 29.072010