Mirabilite: Difference between revisions
Jump to navigation
Jump to search
Weblinks
No edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
<bibimport/> | |||
{{Infobox_Salt | {{Infobox_Salt | ||
|Footnote = <ref>http://webmineral.com/data/Mirabilite.shtml viewed on 29/07/2010</ref><ref>http://www.mindat.org/min-2725.html viewed on 29/07/2010</ref> | |Footnote = <ref>http://webmineral.com/data/Mirabilite.shtml viewed on 29/07/2010</ref><ref>http://www.mindat.org/min-2725.html viewed on 29/07/2010</ref> | ||
| Line 29: | Line 30: | ||
back to [[Sulfate]] | back to [[Sulfate]] | ||
<!-- | |||
== Abstract == | |||
<br> | |||
== Vorkommen von Mirabilit == | |||
siehe [[Natriumsulfat]] | |||
== Angaben zu Herkunft und Bildung von Mirabilit an Baudenkmalen == | |||
siehe [[Natriumsulfat]] | |||
--> | |||
== Solubility properties == | |||
[[file:Loeslichkeit Mirabilit .JPG|thumb|400px|left|'''Figure1''': Solubility of thenardite and mirabilite compared with other salts[after <bib id=Stark.etal:1996/>].]] | |||
<br clear=all> | |||
<!-- | |||
siehe [[Natriumsulfat]] | |||
<br clear=all> | |||
== Hygroskopizität == | |||
[[Datei:Deliqueszenz Mirabilit, Thenardit .JPG|thumb|400px|right|'''Abbildung 2''': Deliqueszenzpunkte der Reinsalze Thenardit und Mirabilit <bib id=Arnold.etal:1991/>]] | |||
In Abbildung 2 ist der Temperatureinfluss auf die Deliqueszenzpunkte von Thenardit und Mirabilit verdeutlicht. Auffällig sind hierbei die gegenläufigen Kurvengänge. | |||
In Anwesenheit von Fremdionen (bei Salzgemischen) verändern sich die Parameter der Gleichgewichtsfeuchte und der notwendigen Temperatur- und Feuchtebedingungen für Umkristallisationen zudem deutlich. Als orientierende Daten sind in Tabelle 1 experimentell erfasste Werte der Gleichgewichtsfeuchte in unterschiedlichen Salzgemischen wiedergegeben. Es zeigt sich, dass alle Werte der Gleichgewichtsfeuchte unter denen des Reinsalzes Mirabilit liegen. | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | |||
|+''Tabelle 1: Angaben der Gleichgewichtsfeuchten über gesättigten Mischlösungen (Mischungsverhältnis: Gesättigte Lsg.A/ gesättigte Lsg.B =1:1) <bib id="Vogt.etal:1993"/>.'' | |||
|- | |||
|bgcolor = "#F0F0F0"| | |||
|bgcolor = "#F0F0F0"| '''MgSO<sub>4</sub>''' | |||
|bgcolor = "#F0F0F0"| '''Ca(NO<sub>3</sub>)<sub>2</sub>''' | |||
|bgcolor = "#F0F0F0"| '''KNO<sub>3</sub>''' | |||
|- | |||
|bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub> • 10H<sub>2</sub>O''' | |||
|bgcolor = "#FFFFEO"| 87(21°C) | |||
|bgcolor = "#FFFFEO"| 74 (21°C) | |||
|bgcolor = "#FFFFEO"| 81(21°C) | |||
|} | |||
<br clear="all"> | |||
'''Feuchtesorption ''' | |||
Als weitere Angabe zur Abschätzung der Hygroskopizität von Natriumsulfaten sind in der nachstehenden Tabelle Werte für das Sorptionsverhalten des Reinsalzes und des Gemisches mit Halit bei unterschiedlichen relativen Feuchten wiedergegeben: | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | |||
|+''Tabelle 2: Feuchtsorption in M.% nach 56 Tagen Lagerung von Natriumsulfat <bib id=Vogt.etal:1993/>'' | |||
|- | |||
|bgcolor = "#F0F0F0"| '''Lagerungsfeuchte''' | |||
|bgcolor = "#F0F0F0" align=center| '''87% r.F.''' | |||
|bgcolor = "#F0F0F0" align=center| '''81% r.F.''' | |||
|bgcolor = "#F0F0F0" align=center| '''79% r.F.''' | |||
|- | |||
|bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>''' | |||
|bgcolor = "#FFFFEO" align=center| 79 | |||
|bgcolor = "#FFFFEO" align=center| 0 | |||
|bgcolor = "#FFFFEO" align=center| 0 | |||
|- | |||
|bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>+NaCl'''<br>(1:1 molare Mischung) | |||
|bgcolor = "#FFFFEO" align=center| 157 | |||
|bgcolor = "#FFFFEO" align=center| 32 | |||
|bgcolor = "#FFFFEO" align=center| 15 | |||
|} | |||
<br clear="all"> | |||
== Kristallisationsdruck == | |||
Bei der Kristallisation aus wäßriger Lösung läßt sich für Mirabilit ein Kristallisationsdruck von 7,2-8,3 N/mm<sup>2</sup> angeben. | |||
== Hydratationsverhalten == | |||
siehe [[Natriumsulfat]] | |||
== Analytischer Nachweis == | |||
===Mikroskopie<br> === | |||
'''Laboruntersuchung:'''<br>Durch mikroskopische Beobachtungen des Lösungsverhaltens sind die gute Wasserlöslichkeit und Ethanolunlöslichkeit zu verifizieren. Thenardit und Mirabilit besitzen keine morphologische Charakterisitka, die bei einfachen Rekristallisationsversuchen zur Identifizierung beitragen können. Vielmehr ist eine große Bandbreite unterschiedlichster Erscheinungsformen beobachtbar.<br> | |||
'''Brechungsindizes:''' n<sub>x</sub> = 1,395; n<sub>y</sub> =1,396-1,410; n<sub>z</sub> =1,398-1,419<br>'''Doppelbrechung''': Δ = 0.04-0,023<br>'''Kristallklass'''e: monoklin<br> | |||
<br> | |||
'''Polarisationsmikroskopische Untersuchung:'''<br> | |||
In Abhängigkeit von den vorliegenden Luftfeuchte- und Temperaturbedingungen verändern Kristalle des Rohprobematerials und des rekristallisierten Präparates ihren Kristallwassergehalt. An trockner Luft (mit r.F. < 80% und Raumtemperatur) verliert Mirabilit sein Kristallwasser und geht in Thenardit über. Dieser Vorgang kann mikroskopisch klar nachvollzogen werden, wenn der Prozeß der Rekristallisation beobachtet wird. Mirabilit weist charakteristische anormale Interferenzfarbe auf, im Zuge des Wasserverlustes und Entstehen von Thenardit schwächen sich die anormalen Interferenzphänomene zunehmend ab.<br><br>'''Verwechslungsmöglichkeiten:''' | |||
Generell ist die Unterscheidung einer bestimmten Anzahl von Sulfaten (die unten aufgelistet sind und wozu Thenardit zählt) ohne mikrochemische Bestimmung der Anionen problematisch, da die Brechungsindizes der Salze dicht beieinander liegen, und alle Salze eine niedrige Doppelbrechung aufweisen. Hilfreich ist die Verwendung eines Immersionsmittels mit einem n<sub>D</sub>-Wert von 1,48. Eine Differenzierung innerhalb dieser Gruppe wird damit möglich. Außerdem können die unten genannten Eigenschaften als Abgrenzungskriterien hinzugezogen werden. | |||
Eindeutig bestimmbar wird Thenardit durch die Möglichkeit, nach Auflösung des Probematerials im Zuge der Rekristallisation das Phänomen anormaler Interferezfarben beobachten zu können, sprich Mirabilit in der hohen Hydratstufe zu identifizieren, und somit indirekt Thenardit nachzuweisen. | |||
<br clear="all"> | |||
{|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | |||
|+''Tabelle 3: Unterscheidungsmerkmale zu Thenardit und Mirabilit'' | |||
|- | |||
|bgcolor = "#F0F0F0"|'''Salzphase''' | |||
|bgcolor = "#F0F0F0"|'''Unterscheidungsmerkmale''' | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Boussingaultit''' (NH<sub>4</sub>)<sub>2</sub>Mg(SO)<sub>4</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"| keine anormalen Interferenzfarben / schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Pikromerit''' K<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"|keine anormalen Interferenzfarben / schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Bloedit''' Na<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | |||
|bgcolor = "#FFFFEO"|alle Indizes >1,48 / keine anormalen Interferenzfarben / schiefe Auslöschung / optisch negativ orientiert | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Glaserit''' K<sub>3</sub>Na(SO<sub>4</sub>)<sub>2</sub> | |||
|bgcolor = "#FFFFEO"|alle Indizes >1,48 / keine anormalen Interferenzfarben/schiefe Auslöschung | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Arkanit''' K<sub>2</sub>SO<sub>4</sub> | |||
|bgcolor = "#FFFFEO"|alle Indizes >1,48 / keine anormalen Interferenzfarben | |||
|- | |||
|bgcolor = "#F7F7F7"|'''Magnesiumformiat''' Mg(HCO<sub>2</sub>)<sub>2</sub> • 2H<sub>2</sub>O | |||
|bgcolor = "#FFFFEO"|vergleichsweise hohe Doppelbrechung / keine anormalen Interfernzfarben / schiefe Auslöschung | |||
|} | |||
<br> | |||
'''Betrachtung von Mischsystemen:''' | |||
Mischsystem Na<sup>+</sup>– Ca<sup>2+</sup>– SO<sub>4</sub> <sup>2-</sup>: Der Ausfall von Gips erfolgt im Zuge der Rekristallisation entsprechend der geringeren Löslichkeit desselben zuerst. Der charakteristische nadelige Habitus von einzelnen Gipskristallen wie auch von Aggregaten bleibt bestehen. Der Ausfall von Natriumsulfat erfolgt später, das eigentliche Kristallwachstum vollzieht sich merklich schneller. Die Morphologie ist unspezifisch. | |||
Mischsystem Na<sup>+</sup>– SO<sub>4</sub> <sup>2-</sup>– Cl<sup>-</sup>: Der Ausfall der beiden Partikelsorten beginnt etwa zeitgleich. Halit mit charakteristischer Morphologie, Natriumsulfat in extrem variierender Gestalt. | |||
--> | |||
<!-- | |||
== Röntgendiffraktometrie == | |||
== Raman-Stektroskopie == | |||
== DTA / TG == | |||
== IR-Spektroskopie == | |||
= Umgang mit Mirabilitschäden = | |||
--> | |||
<!-- | |||
== Salze und Salzschäden im Bild == | |||
=== Am Objekt === | |||
--> | |||
=== Under the polarising microscope === | |||
<gallery caption="Natriumsulfatktistakkisation/Mirabilite between two glas slides" widths="200px" heights="150px" perrow="3"> | |||
image:HJS_Na2SO4-slides-1-110603.jpg|photo taken with crossed polarisers and red I | |||
image:HJS_Na2SO4-slides-110703-10x-2.jpg|photo taken with crossed polarisers | |||
</gallery> | |||
<!-- | |||
=== Unter dem Rasterelektronenmikroskop === | |||
<gallery perrow="4" heights="200px" widths="180px" caption=""> | |||
</gallery> | |||
--> | |||
== Weblinks<br> == | |||
<references /> | |||
== Literatur == | |||
<bibprint/> | |||
[[Category:Mirabilite]][[Category:Sulphate]][[Category:Salt]][[Category:InProgress]][[Category:Sulfate]] | [[Category:Mirabilite]][[Category:Sulphate]][[Category:Salt]][[Category:InProgress]][[Category:Sulfate]] | ||
Revision as of 16:08, 26 December 2011
<bibimport/>
| Mirabilite[1][2] | |

| |
| Mineralogical name | Mirabilite |
| Chemical name | Sodiumsulfate decahydrate |
| Trivial name | Glauber salt, Reussin, Sulphate of Soda |
| Chemical formula | Na2SO4•10H2O |
| Other forms | Sodiumsulphate heptahydrate Na2SO4•7H2O |
| Crystal system | monoclinic |
| Crystal structure | |
| Deliquescence humidity 20°C | 93.6% (20°C), 90% (23°C), 87% (25°C) |
| Solubility (g/l) at 20°C | 900 g/l |
| Density (g/cm³) | 1.464 g/cm³ |
| Molar volume | 219.8 cm3/mol |
| Molar weight | 322.21 g/mol |
| Transparency | transparent to opaque |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | soluble in water and glycerin, not soluble in pure alcohol easily loses some water, converts to thenardite at 32°C anormal blue or brown interference colours |
| Crystal Optics | |
| Refractive Indices | nx = 1.395 ny = 1.396-1.410 nz = 1.398-1.419 |
| Birefringence | Δ = 0.04-0.023 |
| Optical Orientation | negative |
| Pleochroism | |
| Dispersion | |
| Used Literature | |
| {{{Literature}}} | |
back to Sulfate
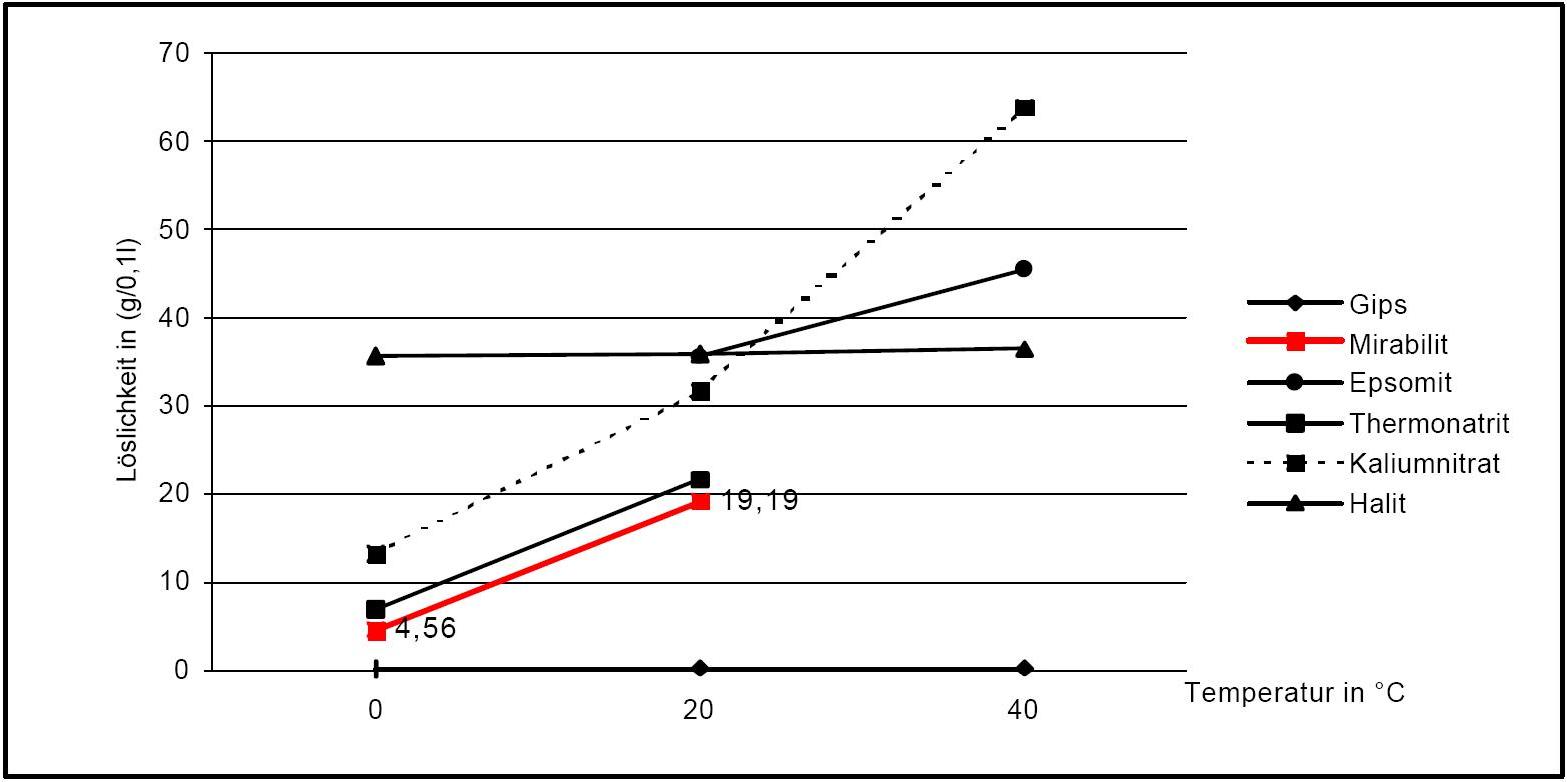
Solubility properties[edit]

Figure1: Solubility of thenardite and mirabilite compared with other salts[after [Stark.etal:1996]Title: Bauschädliche Salze
Author: Stark, Jochen; Stürmer, Sylvia
 ].
].
Author: Stark, Jochen; Stürmer, Sylvia
 ].
].
Under the polarising microscope[edit]
- Natriumsulfatktistakkisation/Mirabilite between two glas slides
Weblinks
[edit]
- ↑ http://webmineral.com/data/Mirabilite.shtml viewed on 29/07/2010
- ↑ http://www.mindat.org/min-2725.html viewed on 29/07/2010
Literatur[edit]
[Filter missing]

