Mirabilite: Difference between revisions
Jump to navigation
Jump to search
Weblinks
CGerdwilker (talk | contribs) No edit summary |
|||
| Line 1: | Line 1: | ||
<bibimport/> | <bibimport/> | ||
<br> English version by Christa Gerdwilker | |||
{{Infobox_Salt | {{Infobox_Salt | ||
|Footnote = <ref>http://webmineral.com/data/Mirabilite.shtml | |Footnote = <ref>http://webmineral.com/data/Mirabilite.shtml accessed 29/07/2010</ref><ref>http://www.mindat.org/min-2725.html accessed 29/07/2010</ref> | ||
|photo = [[File:HJS_Na2SO4-slides-110703-10x-1.jpg|300px]] | |photo = [[File:HJS_Na2SO4-slides-110703-10x-1.jpg|300px]] | ||
|mineralogical_Name = Mirabilite | |mineralogical_Name = Mirabilite | ||
|chemical_Name = | |chemical_Name = Sodium sulfate decahydrate | ||
|Trivial_Name = Glauber salt, Reussin, Sulphate of Soda | |Trivial_Name = Glauber salt, Reussin, Sulphate of Soda | ||
|chemical_Formula = Na<sub>2</sub>SO<sub>4</sub>•10H<sub>2</sub>O | |chemical_Formula = Na<sub>2</sub>SO<sub>4</sub>•10H<sub>2</sub>O | ||
|Hydratforms = | |Hydratforms = Sodium sulphate heptahydrate Na<sub>2</sub>SO<sub>4</sub>•7H<sub>2</sub>O | ||
|Crystal_System = monoclinic | |Crystal_System = monoclinic | ||
|Crystal_Structure = | |Crystal_Structure = | ||
| Line 26: | Line 28: | ||
|Phase_Transition = | |Phase_Transition = | ||
|chemBehavior = | |chemBehavior = | ||
|Comments = soluble in water and glycerin,<br> not soluble in pure alcohol<br> easily loses some water, converts to thenardite at 32°C<br> | |Comments = soluble in water and glycerin,<br> not soluble in pure alcohol<br> easily loses some water, converts to thenardite at 32°C<br>abnormal blue or brown interference colors | ||
}} | }} | ||
| Line 35: | Line 37: | ||
<br> | <br> | ||
== | == Occurrence == | ||
see [[sodium sulfate]] | |||
== | == The origins and formation of halite on monuments == | ||
see [[Sodium sulfate]] | |||
--> | --> | ||
== Solubility properties == | == Solubility properties == | ||
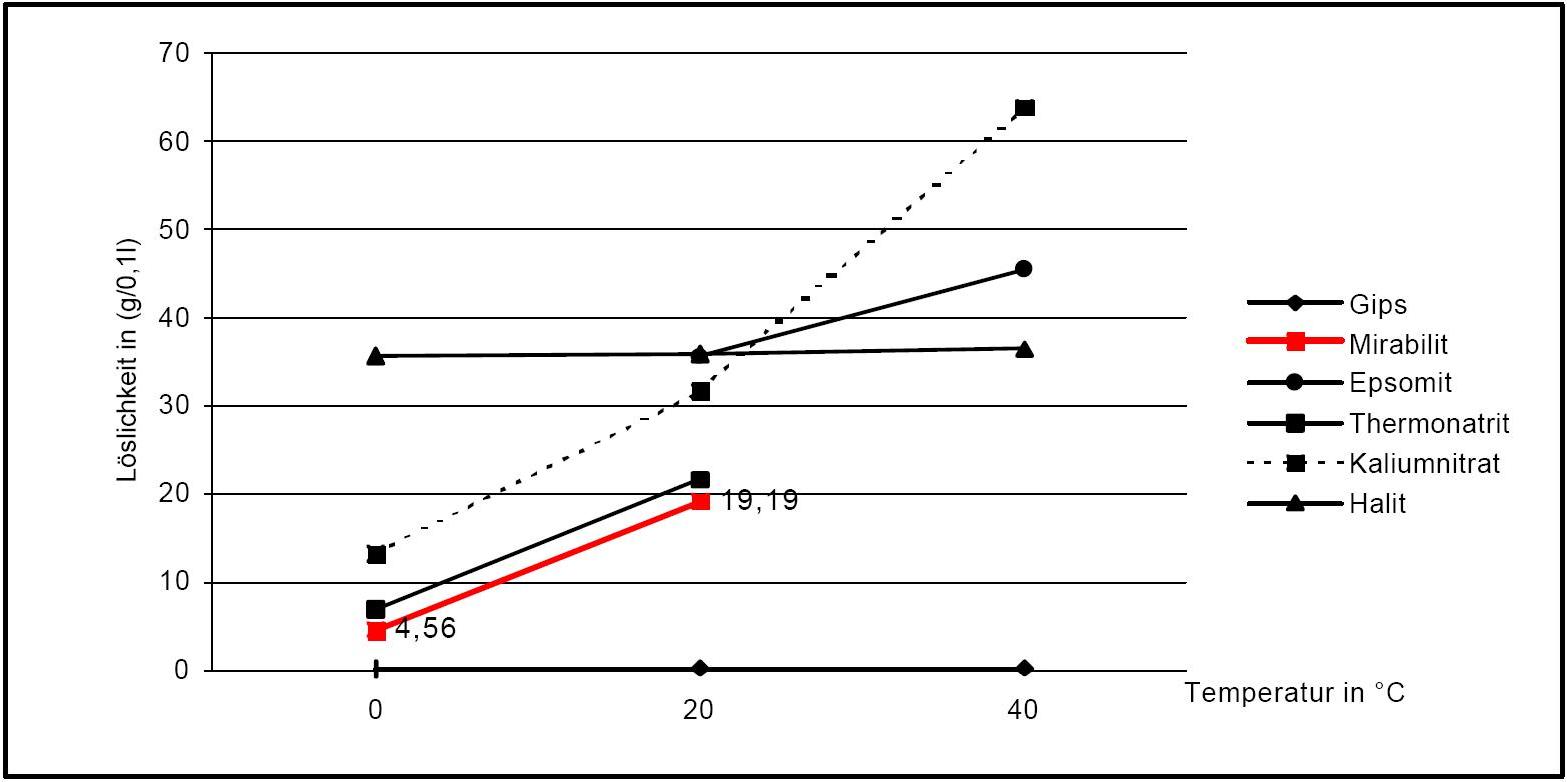
[[file:Loeslichkeit Mirabilit .JPG|thumb|400px|left|'''Figure1''': Solubility of thenardite and mirabilite | [[file:Loeslichkeit Mirabilit .JPG|thumb|400px|left|'''Figure1''': Solubility of thenardite and mirabilite in comparison to other salts[after <bib id=Stark.etal:1996/>].]] | ||
<br clear=all> | <br clear=all> | ||
<!-- | <!-- | ||
see [[Sodium sulfate]] | |||
<br clear=all> | <br clear=all> | ||
== | == Hygroscopicity == | ||
[[Datei:Deliqueszenz Mirabilit, Thenardit .JPG|thumb|400px|right|''' | [[Datei:Deliqueszenz Mirabilit, Thenardit .JPG|thumb|400px|right|'''Figure 2''': Deliquescence points of the pure salts thenardite and mirabilite <bib id=Arnold.etal:1991/>]] | ||
Figure 2 illustrates the influence of temperature on the deliquescence points of thenardite and mirabilite. Note the opposing curves of the graphs. | |||
The presence of other ions (in salt mixtures) can significantly alter the equilibrium humidity parameters, i.e. the temperature and humidity conditions which initiate phase changes. Table 1 lists the experimentally determined equilibrium humidity of different salt mixtures. This shows that the equilibrium humidity of pure mirabilite is higher than that of the other salts. | |||
<br clear="all"> | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | {|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | ||
|+'' | |+''Table1: Equilibrium humidity data of saturated salt mixture solutions (mixing ratio: Saturated solution A/saturated solution = 1:1) <bib id="Vogt.etal:1993"/>.'' | ||
|- | |- | ||
|bgcolor = "#F0F0F0"| | |bgcolor = "#F0F0F0"| | ||
| Line 74: | Line 76: | ||
|} | |} | ||
<br clear="all"> | <br clear="all"> | ||
''' | '''Hygroscopicity ''' | ||
To assess the hygroscopicity of sodium sulfates, the table below compares the moisture sorption of pure sodium sulphate and sodium sulphate-halite mixture at different relative humidity (RH) levels. | |||
<br clear="all"> | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | {|border="2" cellspacing="0" cellpadding="4" width="52%" align="left" class="wikitable sortable" | ||
|+'' | |+''Table 2: Moisture sorption in M.% after 56 days storage of sodium sulphate <bib id=Vogt.etal:1993/>'' | ||
|- | |- | ||
|bgcolor = "#F0F0F0"| ''' | |bgcolor = "#F0F0F0"| '''storage relative RH''' | ||
|bgcolor = "#F0F0F0" align=center| '''87% | |bgcolor = "#F0F0F0" align=center| '''87% RH.''' | ||
|bgcolor = "#F0F0F0" align=center| '''81% | |bgcolor = "#F0F0F0" align=center| '''81% RH''' | ||
|bgcolor = "#F0F0F0" align=center| '''79% | |bgcolor = "#F0F0F0" align=center| '''79% RH''' | ||
|- | |- | ||
|bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>''' | |bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>''' | ||
| Line 92: | Line 94: | ||
|bgcolor = "#FFFFEO" align=center| 0 | |bgcolor = "#FFFFEO" align=center| 0 | ||
|- | |- | ||
|bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>+NaCl'''<br>(1:1 | |bgcolor = "#F7F7F7"| '''Na<sub>2</sub>SO<sub>4</sub>+NaCl'''<br>(1:1 molar mixture) | ||
|bgcolor = "#FFFFEO" align=center| 157 | |bgcolor = "#FFFFEO" align=center| 157 | ||
|bgcolor = "#FFFFEO" align=center| 32 | |bgcolor = "#FFFFEO" align=center| 32 | ||
| Line 99: | Line 101: | ||
<br clear="all"> | <br clear="all"> | ||
== | == Crystallization pressure == | ||
The crystallization of mirabilite from aqueous solution results in a crystallization pressure of 7.2-8.3 N/mm<sup>2</sup>. | |||
== | == Hydration behavior == | ||
see [[Sodium sulfate]] | |||
== | == Analytical evidence == | ||
=== | ===Microscopy<br> === | ||
''' | '''Laboratory analysis:'''<br> Observations of the solubility behavior through the microscope allow the verification of sodium sulfate’s good water solubility and insolubility in ethanol. Thenardite and mirabilite do not have morphological characteristics to aid their identification during simple recrystallization experiments. Instead, a broad range of different forms could be observed.<br> | ||
''' | '''Refractive indices:''' n<sub>x</sub> = 1,395; n<sub>y</sub> =1.396-1.410; n<sub>z</sub> =1.398-1.419<br>'''Birefringence''': Δ = 0.04-0,023<br>'''Crystal class'''e: monocline<br> | ||
<br> | <br> | ||
''' | '''Under the polarizing microscope:'''<br> | ||
The water of crystallization content of the sample and re-crystallized material depends on the ambivalent RH and temperature levels. In dry air (with 80% RH at room temperature) mirabilite loses its water of crystallization content and changes to thenardite. This process can be observed during recrystallization under the microscope. Mirabilite has characteristic abnormal interference colours which weaken during water loss and the formation of thenardite.<br><br>'''Differentiation from different salts:''' | |||
Generally, the differentiation of certain sulfates (listed below and including thenardite) without the microchemical determination of the anions is problematic as their refractive indices are close to each other and all salts display a slight double refraction. The use of an immersion material with a n<sub>D</sub>-value of 1.48 is helpful and allows the differentiation of salts within this group. Additionally, the properties listed below can also be taken into consideration. Thenardite can be determined indirectly through the observation of mirabilite during the high hydration stages of salt recrystallization. | |||
<br clear="all"> | <br clear="all"> | ||
{|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | {|border="2" cellspacing="0" cellpadding="4" width="100%" align="left" class="wikitable" | ||
|+'' | |+''Table 3: Differing characteristics of thenardite and mirabilite'' | ||
|- | |- | ||
|bgcolor = "#F0F0F0"|''' | |bgcolor = "#F0F0F0"|'''Salt phase''' | ||
|bgcolor = "#F0F0F0"|''' | |bgcolor = "#F0F0F0"|'''Characteristics''' | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Boussingaultite''' (NH<sub>4</sub>)<sub>2</sub>Mg(SO)<sub>4</sub> • 6H<sub>2</sub>0 | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"| no abnormal interference colors/oblique extinction | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Picromerite''' K<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"| no abnormal interference colors/oblique extinction | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Bloedite''' Na<sub>2</sub>Mg(SO<sub>4</sub>)<sub>2</sub> • 6H<sub>2</sub>0 | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"|all indices >1.48 / no abnormal interference colors/oblique extinction / negative optical orientation | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Glaserite''' K<sub>3</sub>Na(SO<sub>4</sub>)<sub>2</sub> | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"| all indices >1.48 / no abnormal interference colors/oblique extinction | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Arcanite''' K<sub>2</sub>SO<sub>4</sub> | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"| all indices >1.48 / no abnormal interference colors | ||
|- | |- | ||
|bgcolor = "#F7F7F7"|''' | |bgcolor = "#F7F7F7"|'''Magnesium formate''' Mg(HCO<sub>2</sub>)<sub>2</sub> • 2H<sub>2</sub>O | ||
|bgcolor = "#FFFFEO"| | |bgcolor = "#FFFFEO"|relatively high birefringence/ no abnormal interference colors/oblique extinction | ||
|} | |} | ||
<br> | <br> | ||
''' | '''Mixtures:''' | ||
Mixed systems Na<sup>+</sup>– Ca<sup>2+</sup>– SO<sub>4</sub> <sup>2-</sup>: Due to its poorer solubility, gypsum precipitates first during re-crystallization. The characteristic needle shapes of the individual gypsum crystals as well as those of the aggregates remain. The precipitation of sodium sulfate occurs later, the crystal growth is noticeably faster, the morphology is non-specific. | |||
Mixed system Na<sup>+</sup>– SO<sub>4</sub> <sup>2-</sup>– Cl<sup>-</sup>: The precipitation of both types of particles begins approx. simultaneously. Halite has a characteristic morphology whereas sodium sulfate occurs in extremely varying forms. | |||
--> | --> | ||
<!-- | <!-- | ||
== | == X-ray diffraction == | ||
== Raman- | == Raman-Spectroscopy == | ||
== DTA / TG == | == DTA / TG == | ||
== IR- | == IR-Spectroscopy == | ||
= | = Dealing with mirabilite damage = | ||
--> | --> | ||
<!-- | <!-- | ||
== | == Images of salts and salt decay == | ||
=== | === In situ === | ||
--> | --> | ||
=== Under the | === Under the polarizing microscope === | ||
<gallery caption="Sodium sulfate | <gallery caption="Sodium sulfate crystallization between two glass slides" widths="200px" heights="150px" perrow="3"> | ||
image:HJS_Na2SO4-slides-1-110603.jpg|Photo taken | image:HJS_Na2SO4-slides-1-110603.jpg|Photo taken through crossed polars and red I | ||
image:HJS_Na2SO4-slides-110703-10x-2.jpg|Photo taken | image:HJS_Na2SO4-slides-110703-10x-2.jpg|Photo taken through crossed polars | ||
</gallery> | </gallery> | ||
<!-- | <!-- | ||
=== | === Through the Scanning Electron Microscope === | ||
<gallery perrow="4" heights="200px" widths="180px" caption=""> | <gallery perrow="4" heights="200px" widths="180px" caption=""> | ||
| Line 198: | Line 199: | ||
[[Category:Mirabilite]][[Category: | [[Category:Mirabilite]][[Category:Sulfate]][[Category:Salt]][[Category:InProgress]][[Category:Sulfate]] | ||
Revision as of 12:57, 16 February 2012
<bibimport/>
English version by Christa Gerdwilker
| Mirabilite[1][2] | |

| |
| Mineralogical name | Mirabilite |
| Chemical name | Sodium sulfate decahydrate |
| Trivial name | Glauber salt, Reussin, Sulphate of Soda |
| Chemical formula | Na2SO4•10H2O |
| Other forms | Sodium sulphate heptahydrate Na2SO4•7H2O |
| Crystal system | monoclinic |
| Crystal structure | |
| Deliquescence humidity 20°C | 93.6% (20°C), 90% (23°C), 87% (25°C) |
| Solubility (g/l) at 20°C | 900 g/l |
| Density (g/cm³) | 1.464 g/cm³ |
| Molar volume | 219.8 cm3/mol |
| Molar weight | 322.21 g/mol |
| Transparency | transparent to opaque |
| Cleavage | perfect |
| Crystal habit | |
| Twinning | |
| Phase transition | |
| Chemical behavior | |
| Comments | soluble in water and glycerin, not soluble in pure alcohol easily loses some water, converts to thenardite at 32°C abnormal blue or brown interference colors |
| Crystal Optics | |
| Refractive Indices | nx = 1.395 ny = 1.396-1.410 nz = 1.398-1.419 |
| Birefringence | Δ = 0.04-0.023 |
| Optical Orientation | negative |
| Pleochroism | |
| Dispersion | |
| Used Literature | |
| {{{Literature}}} | |
back to Sulfate
Solubility properties[edit]

Figure1: Solubility of thenardite and mirabilite in comparison to other salts[after [Stark.etal:1996]Title: Bauschädliche Salze
Author: Stark, Jochen; Stürmer, Sylvia
 ].
].
Author: Stark, Jochen; Stürmer, Sylvia
 ].
].
Under the polarizing microscope[edit]
- Sodium sulfate crystallization between two glass slides
Weblinks
[edit]
- ↑ http://webmineral.com/data/Mirabilite.shtml accessed 29/07/2010
- ↑ http://www.mindat.org/min-2725.html accessed 29/07/2010
Literatur[edit]
[Filter missing]

